Exemplo: Suponha que precisamos encontrar a concentração (em gramas por litro) de uma solução feita dissolvendo 1/2 colher de chá de sal em 2 litros de água. Também sabemos que 1 colher de chá de sal é cerca de 6 gramas. Neste caso a conversão é fácil - multiplique: 1/2 colheres de chá x (6 gramas/1 colher de chá) = 3 gramas de sal. 3 gramas de sal dividido por 2 litros de água = 1.5g/L Exemplo: Suponha que queremos encontrar a molaridade da solução salina acima. Para recapitular, temos 3 gramas de sal (NaCl) em 2 litros de água. Comece descobrindo as massas molares de Na e Cl olhando na tabela periódica. Na = cerca de 23 g/mol e Cl = cerca de 35,5 g/mol. Então, o MM de NaCl = 23 + 35,5 = 58,5 g/mol. 3 gramas NaCl x (1 mol NaCl/58,5 g NaCl) = 0,051 mol NaCl. 0,051 mol NaCl / 2 litros de água = .026 M NaCl Qual é a molaridade do NaCL em uma solução de 400 ml, obtida pela adição de 1.5 gramas de NaCl em água? Qual é a concentração, em ppm, de uma solução feita pela adição de 0,001 g de chumbo (Pb) a 150 L de água?? (1 L de água = 1000 gramas) Nesse caso, o volume da solução aumentará uma pequena quantidade adicionando a substância, então você pode usar o volume do solvente como o volume da solução. Encontre a concentração em gramas por litro de uma solução de 0,1 L feita pela adição de 1/2 mol de KCl à água. Este problema exige que você trabalhe de frente para trás, usando a massa molar de KCL para calcular os gramas de KCl no soluto. Certifique-se de que todo o equipamento seja pré-limpo, enxaguado com água deionizada e seco. Prestar atenção: se a reação entre a solução na bureta e o soluto no frasco não mostrar nenhum sinal de reação, você indicador tem que colocar na bunda. Estes são usados em química para dar um sinal visual quando uma solução atinge o ponto de equivalência ou o ponto final. Os indicadores são geralmente usados para titulações investigando reações ácido-base e redox, mas existem vários outros indicadores também. Consulte um livro de química ou a Internet para encontrar um indicador adequado para sua reação. Se a reação resultar em uma mudança no pH ou potencial, você pode colocar leitores de pH ou um potenciômetro no frasco para medir o progresso da reação química. Para uma titulação mais precisa, monitore o pH ou potencial conforme indicado acima, observando como a reação prossegue cada vez após a adição de uma pequena quantidade de titulante. Plote a acidez da solução ou o potencial contra o volume do titulante adicionado. Você verá mudanças bruscas na inclinação da curva nos pontos de equivalência da reação. Grave o volume final em sua bureta. Ao subtrair isso do volume inicial na bureta, você pode encontrar o volume exato do titulante usado. Por exemplo, suponha que usamos 25 ml de NaOH 0,5 M ao titular uma solução de HCl em água até o ponto de equivalência. A solução de HCl tinha um volume de 60 ml para a titulação. Quantos mols de HCl existem em nossa solução? Para começar, vejamos a equação química para a reação de NaOH e HCl: NaOH + HCl > Hã2O + NaCl Neste caso, 1 molécula de NaOH reage com 1 molécula de HCl para produzir água e NaCl. Então, como você adicionou NaOH apenas o suficiente para neutralizar todo o HCl, o número de mols de NaOH consumido na reação será igual ao número de mols de HCl no frasco. Então vamos descobrir qual é a quantidade de NaOH em mol. 25 ml NaOH = 0,025 L NaOH x (0,5 mol NaOH/1 L) = 0,0125 mol NaOH. Como deduzimos da equação da reação que os mols de NaOH consumidos na reação = os mols de HCl na solução, agora sabemos que existem 0,0125 mols de HCl na solução. Para encontrar a molaridade do exemplo acima, divida os mols de HCl pelo volume no frasco. 0,0125 mol HCl x (1/0,060 L) = 0,208 M HCl. Para converter molaridade em g/L, ppm ou porcentagem de composição, você deve converter os mols de seu soluto em massa (usando a massa molar de seu soluto.) Para ppm e porcentagem de composto, você também precisa converter o volume de sua solução em massa (usando um fator de conversão como densidade, ou apenas pesando-o) e, em seguida, multiplique o resultado por 10 ou 10, respectivamente. 

Titule o nitrato de prata de uma bureta ou pequena agulha hipodérmica na amostra do aquário até que a solução fique turva. Com uma amostra tão pequena, é importante exatamente determine quanto nitrato de prata você adicionou - estude cada gota cuidadosamente. 
Suponha que haja 3mL do AgNO 0,25 M3 foi necessário para que a reação chegasse ao fim e a água não turva mais. 3 mL x 0,25 M = 0,003 L x (.25 mol AgNO3/1 L) = 0,000075 mol AgNO3. Neste caso: 1 mol de AgNO3 reage com 1 mol de NaCl. Mas se 1 mol de titulante reage com 2 mols de nosso soluto, então multiplicamos os mols de nosso titulante por 2 para obter os mols de nosso soluto. Em contraste, se 2 mols de nosso titulante reagem com 1 mol de nosso soluto, então dividimos o número de mols do titulante por dois. Essas regras correspondem proporcionalmente a 3 mols de titulante e 1 mol de soluto, 4 mols de titulante e 1 mol de soluto, etc. bem como 1 mol de titulante e 3 moles de soluto, 1 mol de titulante e 4 moles de soluto, etc. MM Na = 22.990. MM Cl = 35.453. 22,990 + 35,453 = 58,443 g/mol 0,000075 mol NaCl x 58,442 g/mol = 0,00438 mol NaCl. Prestar atenção: Se houver mais de um tipo de molécula em um átomo, você terá que adicionar a massa molar desse átomo várias vezes. Por exemplo, se você pegar a massa molar de AgNO3, Se você quiser encontrá-lo, você teria que adicionar a massa ou oxigênio três vezes porque há três átomos de oxigênio na molécula. A salinidade da água do mar é de cerca de 35 g NaCl/L. Nosso aquário não é salgado o suficiente para peixes marinhos.
Determinando a concentração de uma solução
Contente
Em Química ou Química um solução uma mistura homogênea de duas coisas - um substância dissolvida e um solvente ou solvente em que a substância é dissolvida. Concentração é uma medida da quantidade de soluto em um solvente. Pode haver muitas razões para determinar a concentração de uma solução, mas a química envolvida é a mesma, quer você esteja testando o nível de cloro em uma piscina ou realizando uma análise que salva vidas em uma amostra de sangue. Este guia ensinará algumas partes fundamentais da química de soluções e, em seguida, orientará você pelo procedimento de uma aplicação prática comum - manutenção de aquários.
Degraus
Parte 1 de 3: O básico das concentrações
1. Notação de concentrações. A concentração de uma substância é a quantidade desse soluto dividida pela quantidade de solvente. No entanto, como existem diferentes maneiras de expressar a quantidade de uma determinada substância, também é possível expressar uma concentração de maneiras diferentes. Aqui estão as grafias mais comuns:
- Gramas por litro (g/L.) A massa de um soluto em gramas dissolvida em um determinado volume de uma solução (que não é necessariamente o mesmo que o volume do solvente.) Geralmente usado para soluções de sólidos em solventes líquidos.
- Molaridade (M.) O número de mols de um soluto dividido pelo volume da solução.
- Partes por milhão (ppm.) A razão do número de partículas (geralmente em gramas) de um soluto por um milhão de partes de uma solução multiplicada por 10. Geralmente usado para solução muito diluída em água (1 L de água = 1000 gramas.)
- Porcentagem de Tecido Composto. A proporção de partículas (novamente em gramas) de um soluto por 100 partículas de uma solução, expressa em porcentagem.
2. Saiba quais dados você precisa para encontrar uma concentração. Exceto para molaridade (veja abaixo), as grafias usuais de uma concentração, conforme indicado acima, exigem que você conheça a massa do soluto e a massa ou volume da solução resultante. Muitos problemas de química que exigem encontrar a concentração de uma solução não fornecem essa informação. Se este for o caso, você terá que trabalhar com o que sabe para obter essas informações.
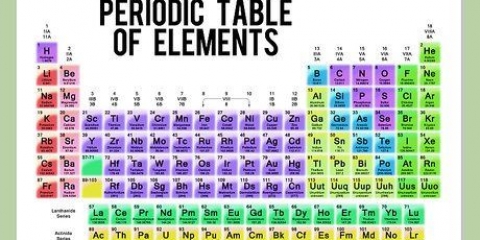
3. Aprenda a calcular a molaridade. A molaridade exige que você conheça os mols do seu soluto, mas você pode deduzir isso facilmente se souber a massa do soluto e sua fórmula química. Cada elemento químico tem um "massa molar" (MM) - uma massa específica para um mol desse elemento. Essas massas molares podem ser encontradas na tabela periódica (geralmente sob o símbolo químico e o nome do elemento.) Basta somar as massas molares dos componentes do soluto para calcular a massa molar. Em seguida, multiplique a massa conhecida do soluto por (1/MM do seu soluto) para encontrar a quantidade de seu soluto em mols.
4. Pratique exercícios padrão sobre o cálculo de concentrações. O conhecimento acima é tudo que você precisa para calcular as concentrações em situações simples. Se você conhece a massa ou volume da solução e a quantidade de soluto inicialmente adicionada, ou pode deduzir isso das informações fornecidas no exercício, você deve ser capaz de calcular a concentração de uma solução com facilidade. Crie exercícios práticos para melhorar suas habilidades. Veja os exemplos de atribuições abaixo:
Parte 2 de 3: Titulação
1. Entendendo quando aplicar uma titulação. A titulação é uma técnica usada pelos químicos para calcular a quantidade de soluto presente em uma solução. Para realizar uma titulação, você fornece uma reação química entre o soluto e outro reagente (geralmente também dissolvido). Como você sabe a quantidade exata de seu segundo reagente e conhece a equação química da reação entre o reagente e o soluto, você pode calcular a quantidade de seu soluto medindo a quantidade de reagente necessária para a reação com o soluto. completo.
- Assim, as titulações podem ser muito úteis no cálculo da concentração de uma solução se você não sabe quanto soluto foi adicionado em princípio.
- Se você sabe a quantidade de soluto presente na solução, não há necessidade de titulação – basta medir o volume de sua solução e calcular a concentração, conforme descrito na Parte 1.
2. Configure seu equipamento de titulação. Para realizar titulações precisas, você precisa de equipamentos limpos, precisos e profissionais. Use um erlenmeyer ou béquer sob uma bureta calibrada, presa a um porta-bureta. O bico da bureta deve caber no gargalo do frasco ou béquer sem tocar nas paredes.
3. Encha o frasco e a bureta. Meça com precisão uma pequena quantidade da solução desconhecida. Quando a substância é dissolvida, ela se espalha uniformemente por todo o solvente, de modo que a concentração dessa pequena amostra da solução será a mesma da solução original. Encha sua bureta com uma solução de concentração conhecida que reagirá com sua solução. Anote o volume exato da solução na bureta – subtraia o volume final para encontrar a solução total usada na reação.
4. Comece com a titulação. Adicione gradualmente uma solução da bureta (de "titulante") no frasco. Use um agitador magnético ou um agitador de vidro para misturar suavemente a solução enquanto a reação está em andamento. Se a sua solução reagir visivelmente, você deve ver alguns sinais de que uma reação está em andamento - mudança de cor, bolhas, resíduos, etc. Se você usar um indicador, poderá ver uma mudança de cor a cada gota que termina no frasco através da bureta.
5. Desacelere sua titulação. À medida que sua reação química se aproxima do ponto final, diminua a titulação até que ela progrida gota a gota. Se você usar um indicador, poderá notar que os flashes coloridos duram mais. Agora continue a titular o mais lentamente possível até que você possa determinar a queda exata que faz com que sua reação atinja o ponto final. No caso de um indicador, você geralmente procura a mudança de cor sustentada mais precoce possível na reação.
6. Calcule a quantidade de soluto em sua solução. Use a equação química para a reação entre o titulante e a solução para encontrar os mols de soluto em seu frasco. Depois de encontrar os mols de soluto, você pode simplesmente dividir pelo volume da solução no frasco para encontrar a molaridade da solução, ou converter os mols para gramas e dividir pelo volume da solução, para obter o concentração em g/L. Isso requer um pouco de conhecimento básico de estequiometria.
7. Calcule a concentração da sua solução. Agora que você sabe a quantidade de soluto em sua solução, é fácil encontrar a concentração em termos de molaridade. Simplesmente divida os mols de soluto em sua solução pelo volume de sua amostra de solução (não o volume da maior quantidade amostrada.) O resultado é a molaridade da sua solução!
Parte 3 de 3: Determinando a salinidade em um aquário

1. Pegue uma amostra de água do seu aquário. Grave o volume com precisão. Se possível, meça o volume em unidades do SI, como mL - elas são fáceis de converter para L.
- Neste exemplo testamos a salinidade da água do aquário, a concentração de sal (NaCl) na água. Suponha que tomemos uma amostra de água para este propósito de 3mL do aquário e, em seguida, definir a resposta final a ser dada em g/L.

2. Titule a amostra de água. Escolha um titulante que produza uma reação claramente visível no soluto. Neste caso, usamos uma solução de 0,25 M AgNO3 (nitrato de prata), um composto que produz um sal de cloro insolúvel quando reage com NaCl na seguinte reação: AgNO3 + NaCl > NaNO3 + AgCl. O sal (AgCl) será visível como um resíduo branco e turvo que flutuará e poderá ser separado da solução.

3. Continue até o comentário parar. Quando o nitrato de prata parar de turvar a solução, você pode registrar o número adicionado de ml. Titule o AgNO3 muito devagar e observe a solução de perto, especialmente à medida que o ponto final se aproxima.
4. Determine o número de mols do titulante. Este passo é fácil - multiplique o volume de titulante que você adicionou pela molaridade. Isso lhe dará o número de mols de titulante usado.
5. Determine o número de mols do seu soluto. Use a equação da reação para a conversão do número de mols de AgNO3 para mols de NaCl. A equação da reação é: AgNO3 + NaCl > NaNO3 + AgCl. Porque 1 mol de AgNO3 reage com 1 mol de NaCl, agora sabemos que o número de mols de NaCl em nossa solução = o número de mols de AgNO3 que foi adicionado: 0,000075 mol.
6. Converta seu número de soluto de mols para gramas. Para fazer isso, você precisará calcular a massa molar do soluto e multiplicá-la pelo número de mols do seu soluto. Para encontrar a massa molar do NaCl, use a tabela periódica para encontrar e somar os pesos atômicos do sal (Na) e do cloreto (Cl).
7. Calcule a concentração final. Temos a massa do nosso soluto em gramas e sabemos o volume da solução de teste. Tudo o que temos a fazer agora é dividir: 0,00438 g NaCl/0,003 L = 1,46 g NaCl/L
Pontas
- Embora o soluto e o solvente possam existir em estados diferentes (sólido, líquido ou gasoso) se estiverem separados, a solução formada quando a substância se dissolve estará no mesmo estado que o estado do solvente.
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
- Use apenas plástico transparente ou vidro.
- Segue um vídeo de exemplo:[1]
Avisos
- Armazene a solução de AgNO3 em um frasco escuro e fechado. É sensível à luz.
- Tenha cuidado ao trabalhar com ácidos ou bases fortes. Certifique-se de que há ar fresco suficiente na sala.
- Use óculos de segurança e luvas.
- Se você quiser recuperar a prata, observe o seguinte: Cu(s) + 2 AgNO3 (aq) → Cu(NO3)2 + 2 Ag (s) Lembre-se que (s) significa sólido.
Artigos sobre o tópico "Determinando a concentração de uma solução"
Оцените, пожалуйста статью
Similar
Popular