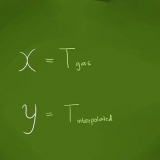Nesta fórmula, n o número de mols, p a pressão, V o volume, t a temperatura em Kelvin e R a constante do gás. Exemplo: n=PV/RT=(0,984 atm x 1 L) / (0,08206 L atm mol-1 K-1 x 318,15 K)=0,0377 mol 
Exemplo: 14,42 g/0,0377 mol=382,49 g/mol 
Exemplo: (12,0107g x 12) + (15,9994g x 1) + (1,00794g x 30)=144,1284 + 15,9994 + 30,2382=190,366g 
Exemplo: 382,49 / 190,366=2,009 
Exemplo: C12OH30 x 2=C24O2H60 

Exemplo: 75,46 g C x (1 mol / 12,0107 g) = 6,28 mol C 8,43 g O x (1 mol / 15,9994 g) = 0,53 mol O 16,11 g H x (1 mol / 1,00794) = 15,98 mol H 
Exemplo: A menor quantidade molar é oxigênio com 0,53 mol. 6,28 mol/0,53 mol=11,83 0,53 mol/0,53 mol=1 15,98 mol/0,53 mol=30,15 
Exemplo: a fórmula da razão torna-se então C12OH30 11,83=12 1=1 30,15=30 


Determinando a fórmula molecular de uma substância
Contente
A fórmula molecular é uma informação importante sobre uma substância química. A fórmula molecular indica quais átomos estão presentes na substância e quantos de cada. Você precisa da fórmula da razão para calcular a fórmula molecular e também precisa saber que a diferença entre essas duas fórmulas é um número inteiro.
Degraus
Parte 1 de 3: Derivando a fórmula molecular de uma fórmula de razão

1. Conhecer a relação entre a fórmula molecular e a fórmula da razão. A fórmula da razão diz algo sobre a razão de átomos dentro de uma molécula, por exemplo, dois átomos de oxigênio em cada átomo de carbono. A fórmula molecular informa quanto de cada um desses átomos está presente na molécula. Por exemplo, um átomo de carbono e dois átomos de oxigênio (dióxido de carbono). Essas duas fórmulas se relacionam entre si por um número inteiro de tal forma que, se a fórmula da razão for multiplicada por essa razão, a fórmula molecular sairá.

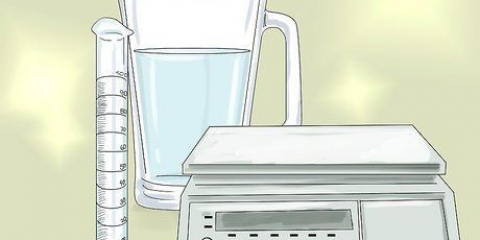
2. Calcule o número de mols de gás. Isso significa que você usa a lei dos gases ideais. Você pode determinar o número de moles com base na pressão, volume e temperatura, conforme fornecido pelos dados dos experimentos. O número de mols pode ser calculado pela fórmula: n=PV/RT.

3. Calcule a massa molecular do gás. Isso só pode ser feito quando o número de mols presentes no gás é conhecido, usando a lei dos gases ideais. Você também precisará saber quantos gramas de um gás está presente. Em seguida, divida o número de gramas de gás pelo número de mols do gás presente, para determinar a massa molecular.

4. Some as massas atômicas de todos os átomos na fórmula da razão. Cada átomo na fórmula da razão tem sua própria massa atômica. Esse valor pode ser encontrado na parte inferior da caixa desse elemento, na tabela periódica. Some essas massas para obter a massa da fórmula da razão.

5. Determine a razão entre a massa molecular e a da fórmula da razão. Isso permite que você determine com que frequência a massa vai para a molécula real de acordo com a fórmula da razão. Se você sabe disso, também sabe quantas vezes a fórmula da razão entra na fórmula molecular. Este deve ser um número inteiro. Se a proporção não for um número inteiro, você terá que arredondar.

6. Multiplique a fórmula da razão pela razão. Multiplique os subscritos da fórmula da razão pela razão. Isso lhe dará a fórmula molecular. Observe que para qualquer substância com uma proporção de `1`, a fórmula da proporção e a fórmula molecular serão as mesmas.
Parte 2 de 3: Determinando a fórmula da razão

1. Determine a massa de cada átomo presente. Às vezes, a massa de cada átomo será dada. Em outro momento, apenas a massa em porcentagem é dada. Se este for o caso, suponha que se trata de uma amostra de 100 g da substância. Com isso, você pode escrever a porcentagem de massa como massa real em gramas.
- Exemplo: 75,46 g C, 8,43 g O, 16,11 g H

2. Converta as massas para o número de mols. Você precisa converter a massa molecular de cada elemento em mol. Para fazer isso, divida a massa molecular pela massa atômica de cada elemento respectivo. Você pode encontrar a massa atômica na parte inferior da caixa desse elemento na tabela periódica.

3. Divida cada valor molar pelo menor valor molar. Você precisa dividir os mols de cada elemento individual pela menor quantidade molar de todos os elementos presentes no composto. Ele permite que você determine as razões molares mais simples. Isso é válido porque o elemento presente em menor quantidade é definido como `1` e fornece as respectivas proporções dos outros elementos no composto.

4. Arredonde os valores molares para inteiros. Esses números tornam-se os subscritos da fórmula da razão. Arredondar para o número inteiro mais próximo. Depois de determinar esses números, você pode escrever a fórmula da razão.
Parte 3 de 3: Entenda a fórmula química

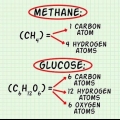
1. Entenda como funciona uma fórmula de proporção. Uma fórmula de proporção fornece informações sobre a proporção de um átomo para outro em uma molécula. Isso não fornece nenhuma informação sobre quantos átomos estão exatamente presentes na molécula. A fórmula da razão também não fornece nenhuma informação sobre a estrutura e a ligação dos átomos em uma molécula.

2. Saiba o que uma fórmula molecular lhe diz. Assim como a fórmula da razão, a fórmula molecular não fornece informações sobre a ligação e a estrutura de uma molécula. Mas, ao contrário da fórmula da razão, a fórmula molecular fornece informações sobre quanto de cada átomo está presente na molécula. A fórmula da razão e a fórmula molecular estão relacionadas entre si de acordo com uma razão inteira.

3. Compreender Fórmulas Estruturais. As fórmulas estruturais fornecem ainda mais informações do que as fórmulas moleculares. Além de indicar o número de átomos em uma molécula, as fórmulas estruturais também fornecem informações sobre as ligações e a estrutura da molécula. Esta informação é crucial para entender como a molécula irá reagir.
Pontas
- Leia a declaração (ou dados) com atenção.
Avisos
- Não confunda a fórmula da razão e a fórmula molecular.
Necessidades
- Tabela Periódica dos Elementos
- Calculadora
- Lápis
- Papel
Artigos sobre o tópico "Determinando a fórmula molecular de uma substância"
Оцените, пожалуйста статью
Similar
Popular