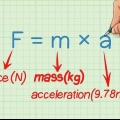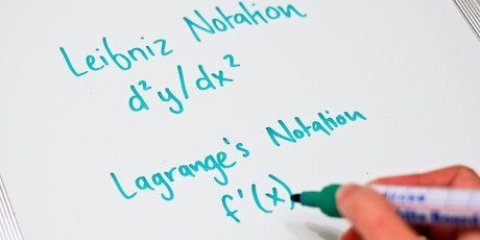No exemplo acima, suponha que você coloque hidrogênio e oxigênio no calorímetro, sele-o e observe uma temperatura (T1) de 150K (que é muito baixa). 

No exemplo, suponha que a segunda temperatura seja (T2) ou 95K. 
No exemplo, você calcula ∆T da seguinte forma:
∆T = T2 – T1 = 95K – 185K = -90K 
No exemplo acima você está usando hidrogênio e oxigênio, que têm massas molares de 2g e 32g, respectivamente. Como você tem 2 mols de hidrogênio e usou 1 mol de oxigênio, pode calcular a massa total dos reagentes da seguinte forma:
2x(2g) + 1x(32g) = 4g + 32g = 36g 
Na fórmula, m é a massa total dos reagentes; s é o calor específico, que também é constante para qualquer elemento ou composto. No exemplo acima, o produto final é água, com calor específico de 4,2 JK-1 g-1. A entalpia da reação pode, portanto, ser calculada da seguinte forma:
∆H=(36g) x (4.2 JK-1 g-1) x (-90K )=-13608 J 
No exemplo acima, a última resposta é -13608 J. Então esta é uma reação exotérmica que usa uma quantidade significativa de energia.
Determinando a entalpia de uma reação
Sempre que você mistura componentes químicos, seja na cozinha ou em um laboratório químico, você cria novas substâncias, o que chamamos de “produtos”. Durante essas reações químicas, o calor pode ser absorvido ou liberado no ambiente. A troca de calor durante uma reação química com o ambiente é conhecida como entalpia de uma reação, escrita como ∆H. Para encontrar ∆H leia o seguinte artigo.
Degraus

1. Prepare os reagentes para a reação química. Para medir corretamente a entalpia de uma reação, você deve primeiro ter a quantidade correta de cada reagente.
- Por exemplo, suponha que você queira encontrar a entalpia da reação na qual a água é formada a partir de hidrogênio e oxigênio: 2H2 (hidrogênio) + O2 (oxigênio)→2H2O (água). Para o propósito deste exemplo, vamos supor que temos 2 mols de hidrogênio e 1 mol de oxigênio.

2. Limpe o recipiente de reação. Para garantir que a reação ocorra sem contaminação, limpe o recipiente de reação (geralmente um calorímetro) que você pretende usar.

3. Coloque um bastão de agitação e um termômetro no recipiente de reação. Prepare a mistura conforme necessário e meça sua temperatura segurando o bastão de agitação e o termômetro no decalorímetro.

4. Despeje os reagentes no recipiente de reação. Quando tudo estiver bem preparado, você pode colocar os reagentes no calorímetro. Feche-o logo em seguida.

5. Meça a temperatura. Usando o termômetro colocado no calorímetro, registre imediatamente a temperatura após a adição dos reagentes.

6. Continuar com o comentário. Dê às substâncias algum tempo para reagir, mexa se necessário para acelerar exatamente.

7. Meça a temperatura novamente. Quando a reação terminar, registre a temperatura novamente.

8. Calcule a diferença de temperatura de T1 e T. Você escreve a diferença como ∆T.
∆T = T2 – T1 = 95K – 185K = -90K

9. Determine a massa total dos reagentes. Se você deseja calcular a massa total dos reagentes, você precisa da massa molar de seus componentes. A massa molar é uma constante; você pode encontrá-los em tabelas periódicas padrão ou outras tabelas de química.
2x(2g) + 1x(32g) = 4g + 32g = 36g

10. Calcule a entalpia da reação. Depois de ter feito isso, você pode determinar a entalpia da reação. A fórmula fica assim: ∆H = (m) x (s) x ( ∆T)
∆H=(36g) x (4.2 JK-1 g-1) x (-90K )=-13608 J

11. Anote o resultado. Se o sinal da sua resposta for negativo, então a reação é exotérmica: calor é perdido para o ambiente. Se o sinal da resposta for positivo, então a reação é endotérmica: o calor é absorvido do ambiente.
Pontas
- Esses cálculos são feitos em Kelvin (K) – uma escala de medição de temperatura como Celsius. Se você quiser converter Kelvin para Celsius, basta adicionar 273 graus: K = C + 273.
Artigos sobre o tópico "Determinando a entalpia de uma reação"
Оцените, пожалуйста статью
Similar
Popular