Exemplo de atribuição: Mol = 0,75 mol de NaCl Volume = 4,2 L 
Exemplo de problema: molaridade = 0,75 mol/4.2L = 0,17857142 
Exemplo de atribuição: 0,179 M NaCl 

Exemplo de atribuição: Massa = 3,4 g KMnO4 Volume = 5,2 L 
Exemplo de atribuição: A massa molar de K = 39,1 g A massa molar de Mn = 54,9 g A massa molar de O = 16,0 g Massa molar total = K + Mn + O + O + O + O = 39,1 + 54.9 + 16 + 16 + 16 + 16 = 158,0 gramas 
Exemplo de problema: gramas de substância * (1/massa molar da substância) = 3,4 g * (1 mol / 158 g) = 0,0215 mol 
Exemplo de problema: molaridade = 0,0215 mol/5.2L = 0.004134615 
Exemplo de atribuição: 0,004 M KMnO4 

Exemplo de atribuição: Número de moles = 1,2 moles de CaCl2 Volume = 2905 ml 
Exemplo de declaração: 2905 ml * (1 L / 1000 ml) = 2905 L 
Exemplo de atribuição: 1,2 mol CaCl2 / 2905L = 0,413080895 
Exemplo de atribuição: 0,413 M CaCl2 

A massa molar de Na = 22,99 g A massa molar de Cl = 35,45 g A massa molar de NaCl = 22,99 + 35.45 = 58,44 gramas 
Mole NaCl = 5,2 g NaCl * (1 mol / 58,44 g) = 0,08898 mol = 0,09 mol 
Você também pode ver isso multiplicando 800 ml por um fator de conversão de 1 L / 1000 ml. Para fazer isso rapidamente, tudo o que você precisa fazer é mover o ponto decimal 3 dígitos para a esquerda, em vez de calcular isso. Volume = 800 ml * (1 L / 1000 ml) = 800 ml / 1000 ml = 0,8 L 
Molaridade = número de mols de substância / número de litros de solução = 0,09 mol / 0,8 L = 0,1125 mol/L 
Responder: 0,11 M NaCl
Calculando a molaridade de uma solução
Contente
Molaridade é uma descrição da relação entre o número de mols de um líquido e seu volume. Para calcular a molaridade você começa com moles e volume, massa e volume ou moles e mililitros. Essas variáveis são então preenchidas na fórmula de cálculo de molaridade padrão para (espero) obter a resposta correta.
Degraus
Método 1 de 4: Calculando a molaridade usando mols e volume

1. Aprenda a fórmula padrão para calcular a molaridade. A molaridade é igual ao número de mols de um soluto dividido pelo volume da solução em litros. Isso já está escrito: molaridade = número de mols de substância / número de litros de solução
- Exemplo de atribuição: Qual é a molaridade de uma solução de 0,75 mol NaCl em 4,2 litros de água?

2. Veja a tarefa. O cálculo da molaridade requer um certo número de mols de substância e número de litros de solução. Se a declaração prevê esses números, nenhum trabalho preparatório precisa ser feito.

3. Divida o número de mols pelo número de litros. A fração que você obtém fornece o número de moles por litro de solução, também conhecido como molaridade.

4. Escreva sua resposta. Complete a resposta corretamente, dependendo dos seus dados de medição e dos requisitos do problema. Curta a palavra "molaridade" fora com "m" e use o nome químico do soluto.
Método 2 de 4: Calculando a molaridade com massa e volume

1. Você conhece a fórmula padrão para calcular a molaridade.molaridade = número de mols de substância / número de litros de solução
- Exemplo de problema: Qual é a molaridade de uma solução dissolvendo 3,4 g de KMnO4 em 5,2 litros ou água?

2. Veja a tarefa. O cálculo da molaridade requer um certo número de mols de substância e número de litros de solução. Se a declaração não fornecer esses números, algum trabalho preliminar deve ser feito antes que você possa continuar.

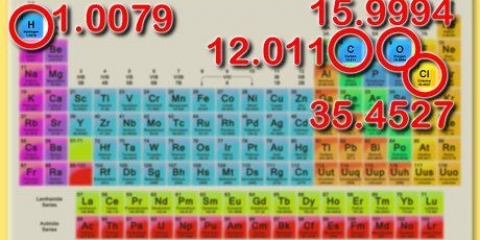
3. Determine a massa molar do soluto. Para encontrar os mols do soluto, é necessário primeiro calcular a massa molar. Você faz isso somando as diferentes massas molares de cada elemento da substância. Esta massa molar pode ser encontrada usando a tabela periódica.

4. Converter gramas em mols. Agora que você conhece a massa molar do soluto, ainda é necessário convertê-la para o número de mols. Você faz isso determinando o peso de 1 mol da substância e, em seguida, multiplicando isso pela massa molar.

5. Divida o número de mols pelo número de litros de solução para encontrar a molaridade.

6. Escreva sua resposta. Complete a resposta corretamente, dependendo dos seus dados de medição e dos requisitos do problema. Curta a palavra "molaridade" fora com "m" e use o nome químico do soluto.
Método 3 de 4: Calculando a molaridade usando mols e mililitros

1. Você conhece a fórmula padrão para calcular a molaridade.molaridade = número de mols de substância / número de litros de solução. Se o volume for dado em mililitros, você terá que convertê-lo.
- Exemplo de problema: Qual é a molaridade de uma solução de 1,2 mol CaCl2 em 2905 mililitros de água?

2. Veja a tarefa. O cálculo da molaridade requer um certo número de mols de substância e número de litros de solução. Se a declaração não fornecer esses números, algum trabalho preliminar deve ser feito antes que você possa continuar.

3. Converter o número de mililitros para litros. Encontre o número de litros da solução dividindo o volume por 1000, ou movendo a vírgula 3 dígitos para a esquerda.

4. Divida o número de mols pelo número de litros. Agora que você tem todos os números em uma linha, você pode calcular a molaridade da solução.

5. Escreva sua resposta. Complete a resposta corretamente, dependendo dos seus dados de medição e dos requisitos do problema. Curta a palavra "molaridade" fora com "m" e use o nome químico do soluto.
Método 4 de 4: Problema de prática extra

1. Queremos determinar a molaridade de uma solução de 5,2 g NaCl em 800 ml de água. Primeiro liste esses valores para maior clareza: massa em gramas e volume em mililitros.
- Massa = 5,2 g NaCl
- Volume = 800ml de água

2. Determine a massa molar do NaCl. Você faz isso adicionando a massa molar de sódio (Na) e a massa molar de cloro (Cl).

3. Multiplique a massa da substância pelo fator de conversão da massa molar. Neste exemplo, a massa molar de NaCl é 58.44 g, então você tem 1 mol / 58,44 g.

4. Divida 800 ml de água por 1000 para obter o número de litros.

5. Divida os mols de uma substância pelos litros da solução. Para encontrar a molaridade, divida 0,09 mol da substância NaCl por 0,8 L da solução.

6. Deixe sua resposta mais clara. Arredonde sua resposta para duas ou três casas decimais e abrevie a molaridade para “M.”
Artigos sobre o tópico "Calculando a molaridade de uma solução"
Оцените, пожалуйста статью
Popular