Li2S = sulfureto de lítio
Ag2S = sulfureto de prata
MgCl2 = Cloreto de magnésio












Nomeando ligações iônicas
Contente
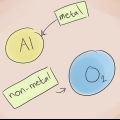
As ligações iônicas consistem em cátions (íons positivos) e ânions (íons negativos). As ligações iônicas geralmente consistem em um metal e um ou mais não metais. Para nomear uma ligação iônica, basta encontrar o nome do cátion e do ânion presentes no composto. Você deve primeiro escrever o nome do metal, seguido pelo nome do não-metal com seu novo final correspondente. Se você quiser saber como nomear ligações iônicas em diferentes situações, basta seguir estes passos.
Degraus
Método 1 de 3: Ligações iônicas básicas

1. Escreva a fórmula da ligação iônica. Digamos que a ligação iônica em que você está trabalhando NaCl é.

2. Anote o nome do metal ou cátion. Este é o íon carregado positivamente na ligação e sempre é escrito primeiro na fórmula de uma ligação iônica. Depois de é sódio. Então escreva Sódio sobre.

3. Escreva o nome do ametal, ou ânion, com o "-idéia" Saída.Cl é cloro (cloro). Em volta do "idéia" para adicionar final, você só precisa da última sílaba "-em" ser substituído por "-idéia". O cloro torna-se cloreto.

4. Combine os nomes. NaCl pode ser escrito como Cloreto de Sódio.

5. Pratique a nomeação de ligações iônicas simples. Uma vez que você tenha sucesso nesta fórmula, tente nomear algumas ligações iônicas mais simples. Memorizar até mesmo alguns pode ajudar a entender melhor como nomear ligações iônicas. Aqui estão mais alguns:



Método 2 de 3: Metais de transição

1. Escreva a fórmula da ligação iônica. Os metais de transição podem ser encontrados no meio da tabela periódica. Eles receberam esse nome porque seus números de oxidação, ou suas cargas, estão mudando constantemente. Digamos que você esteja trabalhando com este título: Fe2O3.

2. Anote a carga do metal. Você sabe que o metal terá uma carga positiva, então você pode usar o 3 de O3 risque e escreva isso Fe tem uma carga de +3. (Você pode, por diversão, fazer o inverso e escrever que O tem uma carga de -2.) Às vezes a cobrança será declarada.

3. Anote o nome do metal. Já que você sabe disso Fe ferro e que tem uma carga de +3, você pode Ferro (III) mencionar. Lembre-se de usar apenas algarismos romanos ao escrever o nome e não ao escrever a fórmula.

4. Anote o nome do não-metal. Já que você sabe disso O significa oxigênio, você pode usar o "-idéia" adicione saída e "óxido" mencionar.

5. Mesclar o primeiro e o segundo nome. Agora você tem isso. Fe2O3 = Óxido de ferro(III).

6. Use o método de nomenclatura mais antigo. Você usa o método de nomenclatura mais antigo, que também é usado, o "ferroso" e "férrico" nomes para os metais, em vez dos algarismos romanos. Se o íon metálico tiver um estado de oxidação mais baixo (uma carga numérica mais baixa, onde você "+" ou "-" ignora), você usa "ferroso". Se tiver uma carga mais alta, use "férrico". Fe tem o estado mais baixo (Fe tem o estado mais alto), então se torna ferroso. O nome do FeO também pode ser escrito como óxido férrico.

7. Lembre-se das exceções. Existem dois metais de transição que não possuem carga fixa. São eles o zinco (Zn) e a prata (Ag). Isso significa que você não precisa usar os algarismos romanos ou o método de nomenclatura mais antigo ao descrever esses elementos.
Método 3 de 3: Ligações com íons poliatômicos

1. Escreva a fórmula do íon poliatômico. Esta ligação consistirá em mais de dois íons. Digamos que você esteja trabalhando no seguinte título: FeNH4(ASSIM4)2.

2. Encontre a carga do metal. Você terá que fazer algumas contas para encontrá-lo. Em primeiro lugar você sabe que o sulfato, ou o SO4 íon, tem uma carga de -2 e que existem dois deles, por causa do 2 abaixo do parêntese. Então, 2 x -2 = -4. Então você sabe que NH4, se o íon amônia, tem uma carga de +1. Adicione -4 e 1 juntos e você obtém -3. Isso significa que o íon de ferro, Fe, deve ter uma carga de +3 para equalizar e tornar a ligação neutra.

3. Anote o nome do metal. Neste caso, você pode tanto Ferro (III) E se férrico escreva.

4. Escreva o nome dos íons não metálicos. Neste caso você usa amônio e sulfato, ou sulfato de amônia.

5. Combine o nome do metal com os nomes dos não-metais. Você pode nomear a ligação FeNH4(ASSIM4)2 passar ou sulfato de amônio de ferro(III) ou sulfato de amônio férrico escrever.
Pontas
- Se você for na direção oposta e tiver números romanos, precisará tirar um “raio-X” da molécula. O numeral romano é a carga do cátion.
Artigos sobre o tópico "Nomeando ligações iônicas"
Оцените, пожалуйста статью
Popular