Exemplo: Al2O3. Já2 = Alumínio; O3 = oxigênio. Então o nome se torna “óxido de alumínio”. 
Exemplo: FeCl2 e FeCl3. Fe = Ferro; Cl2 = Cloreto -2;Cl3 = Cloreto -3. Os nomes seriam cloreto de ferro(II) e cloreto de ferro(III). 

Remova um átomo de oxigênio da ligação. A carga permanece a mesma e o final do nome do título muda de “-aat” para “–iet”. Por exemplo: NÃO3 para NÃO2 muda de “nitrato” para “nitrito.”
Substitua o átomo central por outro do mesmo grupo periódico. Por exemplo: Sulfato SO4 pode se transformar em Selenate SeO4.

Íon hidróxido: OH Íon nitrato: NÃO3 íon carbonato de oxigênio: HCO3 Íon permanganato: MnO4 Íon carbonato: CO3 Íon cromato: CrO4 íon dicromato: Cr2O7 Íon sulfato: SO4 Íon sulfito: SO3 Íon tiossulfato: S2O3<2- íon fosfato: PO4 Íon amônio: NH4 Exemplo: KMnO4. Você pode usar o MnO4 íon deve reconhecer como permanganato. K é potássio, então o nome da ligação é permanganato de potássio.
Exemplo: NaOH. Você deve reconhecer o íon OH como hidróxido. Na é sódio, então o nome da ligação será hidróxido de sódio.


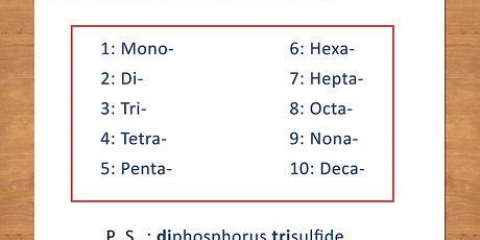
1 átomo – “Mono-“ 2 átomos – “Di-“ 3 átomos – “Tri-“ 4 átomos – “Tetra-“ 5 átomos – “Penta-“ 6 átomos – “Hexa-“ 7 átomos – “Hepta-“ 8 átomos – “Octa-“ Exemplo: CO torna-se monóxido de carbono e CO2 torna-se dióxido de carbono.
Exemplo: N2s3 então se torna trissulfeto de dinitrogênio.
Na maioria dos casos, a preposição “mono-” pode ser omitida, pois significa quando não está presente. Ainda é usado para monóxido de carbono devido ao fato de que o termo está em uso desde o início da química.
Nomenclatura de ligações químicas
Contente
Nomear as ligações químicas padrão é essencial para ter sucesso em química. Siga este guia para algumas regras básicas sobre como as ligações químicas recebem seus nomes e para aprender como nomear ligações químicas com as quais você não está familiarizado.
Degraus
Método 1 de 3: Nomenclatura de ligações iônicas

1. Entenda por que algo é uma ligação iônica. As ligações iônicas contêm um metal e um não metal. Consulte a tabela periódica de elementos para ver a qual categoria os elementos da ligação pertencem.

2. Forme o nome. A nomenclatura de uma ligação iônica de dois elementos é simples. A primeira parte do nome é o nome do metal. A segunda parte é o nome do não metal, com o sufixo “-ide.”

3. Reconhecer metais de transição. Metais nos blocos d e f da tabela periódica são conhecidos como metais de transição. A sua carga é indicada por algarismos romanos, quando se escreve o nome do título. Isso ocorre porque eles podem ter mais de uma carga e formar mais de uma ligação.
Método 2 de 3: A nomenclatura de ligações poliatômicas

1. Entenda o que é uma ligação poliatômica. Essas ligações são feitas de grupos de átomos ligados entre si, com o grupo completo tendo uma carga negativa ou positiva. Você pode fazer três coisas com ligações poliatômicas:
- Adicione um átomo de hidrogênio no início da ligação. A palavra “hidrogênio” é adicionada ao início do nome da ligação. Isso reduz a carga negativa em um. Por exemplo, CO “carbonato”3 torna-se "carbonato de hidrogênio" HCO3.




2. Memorize os grupos de íons mais comuns. Estes formam a base para fazer a maioria das ligações poliatômicas. Em ordem de maior carga negativa são:
3. Crie nomes de associação com base na lista. Inclua todos os elementos pertencentes ao grupo íon no nome. Se o elemento vier antes do grupo iônico, basta adicionar o nome do elemento no início do nome da ligação.


Método 3 de 3: A nomenclatura de ligações covalentes

1. Entenda o que é uma ligação covalente. As ligações covalentes são formadas por dois ou mais não metais. O nome da ligação é baseado na quantidade de átomos presentes. A preposição adicionada é o termo latino para a quantidade de moléculas.

2. Aprenda as preposições. Memorize as preposições de 8 átomos:
3. Nomeie as ligações. Nomeie a nova ligação usando preposições. Você anexa preposições a qualquer parte da ligação que tenha vários átomos.



Pontas
- Também é muito importante entender que isso não se aplica à bioquímica.
- Essas regras são feitas para pessoas que estão começando com química e ciências. Existem regras diferentes quando você chega à química avançada, por exemplo, as regras para valência variável.
- Claro, todas essas regras têm muitas exceções. Por exemplo, embora CaCl 2 a 2 no final, ainda é chamado de cloreto de cálcio e NÃO dicloreto de cálcio, como seria de esperar.
Artigos sobre o tópico "Nomenclatura de ligações químicas"
Оцените, пожалуйста статью
Popular