Em química, os termos significam "oxidação" e "redução" aquelas reações nas quais um átomo (ou um grupo de átomos) perde ou ganha elétrons, respectivamente. Os números de oxidação são números atribuídos a átomos (ou grupos de átomos) para ajudar os químicos a verificar quantos elétrons estão disponíveis para serem deslocados e se determinados reagentes oxidam ou reduzem durante uma reação. O processo de atribuição de números de oxidação aos átomos pode variar do muito simples ao mais complexo, dependendo da carga dos átomos e da composição química das moléculas das quais fazem parte. Para complicar as coisas, alguns átomos podem ter vários números de oxidação. Felizmente, a atribuição de números de oxidação é governada por regras bem definidas e fáceis de seguir, mas um entendimento básico de química e álgebra tornará o uso dessas regras muito mais fácil.
Degraus
Parte 1 de 2: Atribuindo números de oxidação com base em regras químicas
1.
Determine se a substância em questão é elementar. Átomos livres e não ligados sempre têm um número de oxidação de 0. Isso é verdade tanto para átomos que consistem em um único átomo quanto para átomos cuja forma elementar é diatômica ou poliatômica.
- Por exemplo, Al(s) e Cl2 ambos têm o número de oxidação 0 porque não são átomos compostos.
- Observe que o enxofre em sua forma elementar, S8 (octassulfur), embora irregular, também tem um número de oxidação de 0.
2. Determine se a substância em questão é um íon. Os íons têm números de oxidação iguais à sua carga. Isso é verdade tanto para íons não ligados quanto para íons que fazem parte de um íon composto.
Por exemplo, o íon Cl tem um número de oxidação -1.O íon Cl ainda tem um número de oxidação de -1 quando faz parte do composto NaCl. Como o íon Na, por definição, tem carga +1, sabemos que o íon Cl tem carga -1, então o número de oxidação ainda é -1.3. No caso de íons metálicos, é bom lembrar que vários números de oxidação são possíveis. Muitos metais podem ter mais de um patamar. Por exemplo, o ferro metálico (Fe) pode ser um íon com carga +2 ou +3. a carga dos íons metálicos (e, portanto, também de seus números de oxidação) pode ser determinada em relação à carga dos outros átomos da composição de que fazem parte, ou, quando escrita como texto, pela notação em algarismos romanos (como como no sentido: "O íon ferro(III) tem uma carga de +3.").
Por exemplo, vamos examinar um composto contendo um íon de alumínio. O composto AlCl3 tem uma carga 0. Como sabemos que os íons Cl têm carga de -1 e há 3 íons Cl no composto, o íon Al deve ter uma carga de +3, de modo que a carga de todos os íons somados é 0. Então, o número de oxidação do Al é +3.4. Atribua um número de oxidação -2 ao oxigênio (com exceções). Dentro quase todos os casos os átomos de oxigênio têm um número de oxidação de -2. Existem algumas exceções a essa regra:
Quando o oxigênio está no estado elementar (O2), então o número de oxidação é 0, que é o caso de todos os átomos elementares.Quando o oxigênio faz parte peróxido, então o número de oxidação é -1. Os peróxidos são uma classe de substâncias compostas que possuem uma ligação oxigênio-oxigênio (ou o ânion peróxido O2). Por exemplo, na molécula H2O2 (água oxigenada), o oxigênio tem um número de oxidação (e uma carga) de -1.Além disso, quando o oxigênio faz parte de um superóxido, o número de oxidação -0.5 é.Quando o oxigênio está ligado ao flúor, o número de oxidação é +2. Consulte a regra de flúor abaixo para obter mais informações. Eu não2f2) é este +1.5. Atribua um número de oxidação de +1 ao hidrogênio (com exceções). Tal como acontece com o oxigênio, o número de oxidação do hidrogênio depende de casos excepcionais. Em geral, o hidrogênio tem um número de oxidação +1 (exceto na forma elementar, H2). Mas no caso de um composto especial chamado híbrido, o hidrogênio tem um número de oxidação de -1.
Por exemplo, de H2Oh, sabemos que o hidrogênio tem um número de oxidação de +1 porque o oxigênio tem uma carga de -2 e precisamos de 2 cargas +1 para fazer um composto com uma carga total de zero. Mas no caso do hidreto de sódio, NaH, o hidrogênio tem um número de oxidação de -1 porque o íon Na tem uma carga de +1 e, para tornar a carga total do composto 0, o hidrogênio tem uma carga (e, portanto, um número de oxidação ) de - 1.6. O flúor tem sempre um número de oxidação de -1. Como mencionado acima, os números de oxidação de certos elementos podem variar devido a vários fatores (íons metálicos, átomos de oxigênio em peróxidos, etc.). O flúor, por outro lado, tem um número de oxidação de -1, e isso nunca muda. Isso ocorre porque o flúor é o elemento mais eletronegativo, ou seja, é o elemento menos disposto a ceder elétrons e com maior probabilidade de receber elétrons de outros átomos. Portanto, o número de oxidação não mudará.
7. Os números de oxidação em um composto são iguais à carga do composto. Os números de oxidação de todos os átomos de um composto são iguais à carga desse composto. Por exemplo, se um composto não tiver carga, a soma de todos os números de oxidação será zero; se o composto é um íon poliatômico com carga de -1, então os números de oxidação somados devem ser iguais a -1, etc.
Esta é uma boa maneira de verificar sua resposta - se os números de oxidação de um composto não somam a carga desse composto, então você sabe que cometeu um erro.Parte 2 de 2: Atribuindo números a átomos sem as regras do número de oxidação
1.
Encontrar átomos sem regras de número de oxidação. Alguns átomos não seguem as regras para encontrar os números de oxidação. Se um átomo não atender às regras acima e você não tiver certeza de qual é sua carga (por exemplo, se for parte de um composto maior e a carga individual for desconhecida), você poderá encontrar o número de oxidação desse átomo por eliminação. Primeiro você determina a oxidação de todos os outros átomos no composto. Então você resolve a soma da incógnita na equação, com base na carga total do composto.
- Por exemplo, no composto Na2ASSIM4, a carga de enxofre (S) é desconhecida - não está na forma elementar, então não é 0, mas é tudo o que sabemos. Este é um bom candidato para aplicar este método para determinar algebricamente o número de oxidação.

2. Determine os números de oxidação conhecidos dos outros elementos do composto. Usando as regras de atribuição de número de oxidação, determinamos quais números de oxidação os outros átomos do composto têm. Observe exceções como O, H, etc.
em Nac2ASSIM4, sabemos, com base em nosso conjunto de regras, que o íon Na tem uma carga (e, portanto, um número de oxidação) de +1 e que os átomos de oxigênio têm números de oxidação de -2.3. Multiplique o número de cada átomo pelo número de oxidação. Agora que conhecemos os números de oxidação de todos os átomos, exceto o desconhecido, teremos que considerar que alguns desses átomos podem ocorrer mais de uma vez. Multiplique cada coeficiente (escrito em subscrito após o símbolo do átomo no composto) pelo número de oxidação.
Quanto a Na2ASSIM4, sabemos que existem 2 átomos de Na e 4 átomos de O. Agora realizamos o seguinte cálculo, 2 × +1, para obter o número de oxidação de Na, 2, e multiplicamos 4 × -2 , o número de oxidação de O, -8.4. Adicione os resultados juntos. Adicionando os resultados dessas multiplicações dá o número de oxidação do composto,sem para levar em conta o número de oxidação do átomo desconhecido.
Em nosso exemplo com Na2ASSIM4, adicionamos 2 a -8 para obter -6.5. Calcule o número de oxidação desconhecido com base na carga do composto. Agora você tem todos os dados para encontrar o número de oxidação desconhecido usando alguma álgebra simples. Usamos uma equação e a resposta da etapa anterior, mais a carga do composto. Em outras palavras: (Soma dos números de oxidação desconhecidos) +(o número de oxidação desconhecido que você deseja saber) = (carga do composto).
No exemplo de Na2ASSIM4, resolvemos isso da seguinte forma:(Soma dos números de oxidação conhecidos) +(número de oxidação desconhecido que você deseja resolver) = (carga do composto)-6 + S = 0S = 0 + 6S = 6. S tem um número de oxidação ou 6 em Nac2ASSIM4.Pontas
- Átomos em sua forma básica sempre têm um número de oxidação 0. Um íon constituído por 1 átomo tem um número de oxidação igual à carga. Metais do grupo 1A, como hidrogênio, lítio e sódio, têm um número de oxidação de +1; Metais do grupo 2A, como magnésio e cálcio, têm um número de oxidação de +2. Tanto o hidrogênio quanto o oxigênio podem ter 2 números de oxidação diferentes, dependendo de sua ligação.
- Em um composto, a soma de todos os números de oxidação deve ser igual a 0. Se houver um íon com 2 átomos, então a soma dos números de oxidação deve ser igual à carga do íon.
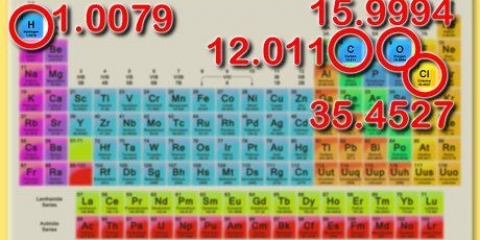
- É muito útil saber ler a tabela periódica e onde encontrar os metais e não metais.
Necessidades
- Tabela Periódica dos Elementos
- Uma conexão com a internet
- Um livro de química
- Papel, caneta ou lápis
- Calculadora
Artigos sobre o tópico "Calculando o número de oxidação de uma substância"