Assim, a massa molar de um elemento é igual à massa molar de um átomo vezes o número de átomos em cada molécula: para o hidrogênio, 1,008 vezes 2, ou 2,016 gramas por mol; oxigênio, 15,9994 vezes 2, ou 31,9988 gramas por mol; e para cloro, 35,453 vezes 2, ou 70,096 gramas por mol. 

A massa molar de cada elemento de cloreto de hidrogênio, HCl, é 1,008 gramas por mol de hidrogênio e 35,453 gramas por mol de cloro. A massa molar de cada elemento da glicose, C6Hã12O6, é 12,0107 vezes 6, ou 72,0642 gramas por mol de carbono; 1,008 vezes 12, ou 12,096 gramas por mol de hidrogênio; e 15,9994 vezes 6, ou 95,9964 gramas por mol de oxigênio. 
A massa molar do cloreto de hidrogênio é 1,008 + 35,453 ou 36,461 gramas por mol. A massa molar da glicose é 72,0642 + 12,096 + 95,9964, ou 180,1566 gramas por mol.
Calculando a massa molar
Contente
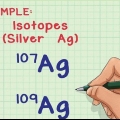
Os átomos são muito pequenos para medições significativas de produtos químicos. Para poder trabalhar com quantidades muito pequenas de uma determinada substância, estas são classificadas pelos cientistas em unidades de mol. Um mol é definido como uma certa quantidade de substância com tantas partículas quanto o número de átomos de carbono em 12 gramas do isótopo C-12, que equivale aproximadamente a 6,022 14 × 10. Isso é chamado de número ou constante de Avogadro . É usado para indicar o número de átomos, moléculas, íons ou partículas subatômicas em qualquer substância, e a massa de 1 mol é a massa molar dessa substância. Aqui você pode ler como calcular a massa molar de elementos e substâncias.
Degraus
Método 1 de 2: Calculando a Massa Molar de um Elemento

1. Encontre a massa atômica relativa do elemento. A massa atômica relativa de um elemento é a média ponderada, expressa em unidades de massa atômica (u), das massas atômicas de todos os isótopos naturais.Você pode encontrar essas informações na tabela periódica. Como exemplo, o hidrogênio tem uma massa atômica relativa de 1,008; carbono 12,0107; oxigênio 15,9994; e cloro 35.453.

2. Multiplique pela massa molar. Isto é definido como 1 grama por mol. Isso converte a unidade de massa atômica em gramas por mol, tornando a massa molar do hidrogênio igual a 1,008 gramas por mol, carbono 12,0107 gramas por mol, oxigênio 15,9994 gramas por mol e cloro 35,453 gramas por mol.
3. Encontre a massa molar de uma molécula bivalente. Alguns elementos só podem ser encontrados em moléculas de 2 ou mais. Isso significa que, se você quiser calcular a massa molar de um elemento composto por, por exemplo, 2 átomos, como hidrogênio, oxigênio e cloro, determine a massa atômica relativa e multiplique-a pela massa molar, e multiplique o resultado por 2.
Método 2 de 2: Calculando a Massa Molar de um Composto

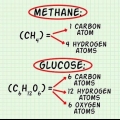
1. Determine a fórmula química do composto. Este é o número de átomos em cada elemento do composto. (Dados sobre isso podem ser encontrados, por exemplo, nas Binas) Por exemplo: a fórmula do cloreto de hidrogênio (ácido clorídrico) é HCl; para glicose C6Hã12O6. A última fórmula significa que a glicose contém 6 átomos de carbono, 12 átomos de hidrogênio e 6 átomos de oxigênio.

2. Determine a massa molar de cada elemento no composto. Multiplique a massa atômica do elemento pela massa molar e o número de átomos do elemento no composto. Veja como isso funciona:

3. Adicione as massas molares de cada elemento no composto. Isso dá a massa molar do composto. Veja como fazer isso:
Pontas
- Enquanto na maioria dos casos as massas atômicas relativas têm uma precisão de 4 casas decimais, no laboratório uma precisão de 2 casas decimais ou menos se aplica a massas excepcionalmente grandes. Assim, no laboratório, a massa molar do cloreto de hidrogênio é 36,46 gramas por mol e a da glicose é 180,16 gramas por mol.
Avisos
- Não confunda massa molar e massa molecular. Este último é a massa de uma molécula individual de um elemento ou composto. A massa molar pode ser entendida como a massa média de todas as moléculas em uma amostra de uma determinada substância, assim como a massa atômica relativa é a média das massas atômicas de todos os isótopos.
Necessidades
- Binas e Tabela Periódica dos Elementos
- Calculadora
Artigos sobre o tópico "Calculando a massa molar"
Оцените, пожалуйста статью
Popular