Como os átomos são extraordinariamente pequenos, os cientistas geralmente trabalham com átomos em quantidades maiores chamadas moinho. Um mol é a quantidade de uma substância com tantos átomos quanto haveria em 12 gramas do isótopo carbono-12. Esse número é cerca de 600 trilhões (6 vezes 10 elevado à 23ª potência) de átomos, e é conhecido como constante de Avogadro, em homenagem ao cientista que o definiu. 


Um livro de referência fornecerá proporções baseadas em todas as quantidades conhecidas de isótopos de um elemento, enquanto o espectrômetro de massa fornecerá as proporções para a amostra que está sendo testada. 
No exemplo acima: 12 x 0,99 = 11,88 para carbono-12 e 13 x 0,01 = 0,13 para carbono-13. A massa atômica relativa é 11,88 + 0,13 = 12,01. (Devido às razões dos isótopos, as massas atômicas relativas nas tabelas periódicas raramente são números inteiros.)
Calcular a massa atômica
Contente
A massa atômica é a massa de um isótopo específico de um determinado átomo, mas também é mal usada para descrever o peso médio de uma amostra de diferentes isótopos do mesmo elemento, que na verdade é chamado de massa atômica relativa ou peso atômico. Seja qual for o valor que você está procurando, mostraremos as etapas para calcular a massa atômica e a massa atômica relativa.
Degraus
Método 1 de 2: Calcular a massa atômica

1. Encontre o número atômico do elemento ou isótopo. O número atômico é o número de prótons em um elemento, e nunca muda. Por exemplo: todos os átomos de hidrogênio, apenas e só átomos de hidrogênio, têm um próton. O carbono tem o número atômico 6 porque seu núcleo tem seis prótons enquanto o oxigênio tem o número atômico 8 porque seu núcleo tem oito prótons.

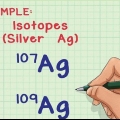
2. Determine o número de nêutrons no núcleo. O número de nêutrons pode variar dentro de um átomo - embora sejam o mesmo elemento, existem diferentes isótopos desse elemento. Dois isótopos do mesmo elemento terão o mesmo número de prótons, mas um número diferente de nêutrons.

3. Ignore o número de elétrons que orbitam o núcleo. A massa dos elétrons de um átomo é desprezível em comparação com os prótons e nêutrons no núcleo.

4. Some o número de prótons e nêutrons. Esta é a massa atômica desse átomo.
Método 2 de 2: Calcular a massa atômica relativa (peso atômico)

1. Determine o número de isótopos na amostra. Quais isótopos estão na amostra pode ser determinado usando um espectrômetro de massa.

2. Determine a abundância relativa de cada isótopo na amostra. Esta informação pode ser obtida por espectrometria de massa ou de um livro de referência.

3. Multiplique a massa atômica de cada isótopo por sua razão na amostra. Em uma amostra contendo carbono-12 e carbono-13, se 99% da amostra for carbono-12, multiplique 12 por 0,99 e 13 por 0,01.

4. Some os resultados. O total é a massa atômica relativa, ou peso atômico, da amostra.
Pontas
- Alguns isótopos são menos estáveis que outros e se decompõem em elementos com menos prótons e nêutrons em seus núcleos enquanto repelem partes de si mesmos. Esses isótopos são chamados de radioativos.
Necessidades
- Espectrômetro de massa
- livro de referência química
- Calculadora
Artigos sobre o tópico "Calcular a massa atômica"
Оцените, пожалуйста статью
Popular