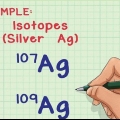
Para o dióxido de carbono (CO2) a massa atômica relativa é 12,011 amu para carbono e 15,999 para oxigênio. A massa atômica de um elemento é aproximadamente igual à soma da massa do número de prótons e nêutrons que ele contém. Observe que a massa atômica relativa que você encontra na tabela periódica é escalonada: leva em conta todos os isótopos do elemento nas proporções que ocorrem naturalmente. 
Em nosso exemplo de dióxido de carbono, a massa do átomo de carbono é 12.011 amu. Como existem dois átomos de oxigênio, escreva isso como  .
. 
Arredonde a resposta quando necessário, usando algarismos significativos. Não se esqueça de usar as unidades corretas. amu é a antiga abreviação para unidade de massa atômica, mas uma unidade melhor e moderna é uma pequena vocês. Para o dióxido de carbono, a massa molecular pode ser encontrada da seguinte forma:  .
. 





Calculando a massa molecular
Contente
A massa molecular, anteriormente chamada de peso molecular (MW), é a massa de todos os átomos em um determinado Fórmula molecular.A massa molecular é medida em unidades de massa atômica, geralmente expressa em vocês ou divertir. Para calcular a massa molecular de uma fórmula, você deve somar as massas atômicas de cada elemento presente.
Degraus
Método 1 de 2: Calculando a Massa Molecular

1. Conte quantos átomos de cada elemento estão na molécula. Primeiro, liste todos os elementos presentes na molécula. Você pode usar o símbolo químico ou escrever o nome do elemento. Em seguida, conte os átomos de acordo com a fórmula molecular e escreva-os ao lado do nome ou símbolo do elemento.
- Por exemplo: dióxido de carbono ou CO2, contém 1 carbono (C) e 2 oxigênio (O).
- Metano, CH4, contém carbono (C) e hidrogênio (H). O metano consiste em 1 átomo de carbono e 4 átomos de hidrogênio.
- glicose, CO6Hã12O6, contém carbono (C), hidrogênio (H) e oxigênio (O). A glicose consiste em 6 átomos de carbono, 12 átomos de hidrogênio e 6 átomos de oxigênio.

2. Especialmassa atômica relativa de cada elemento da molécula. Use-o tabela periódica. A tabela periódica lista a massa atômica de cada elemento sob o símbolo químico. Por exemplo: o oxigênio tem uma massa atômica relativa de 15,9994 amu.

3. Calcule a massa total de cada elemento na molécula. Multiplique a massa atômica de cada elemento pelo número de átomos desse elemento: (massa atômica do elemento) x (número de átomos desse elemento). Faça isso para cada elemento da molécula.
 .
.
4. Some as massas de todos os átomos para encontrar a massa molecular. Massa molecular = ∑((massa atômica do elemento)n x (número de átomos desse elemento)n)
 .
.Método 2 de 2: Pratique com exemplos

1. Determine a massa molecular do metano (CH4). A massa atômica do hidrogênio é 1,008 u. A massa atômica do carbono é 12.011 u. Existem quatro átomos de hidrogênio no metano. Some o peso de todos os átomos do metano para encontrar a massa molecular.
.

2. Calcule a massa molecular da glicose (C6Hã12O6). A massa atômica do carbono é 12.011 u. A massa atômica do hidrogênio é 1,008 u. A massa atômica do oxigênio é 15.999 Existem 6 átomos de carbono, 12 átomos de hidrogênio e 6 átomos de oxigênio. Some as massas de todos os átomos da glicose para calcular a massa molecular.




Pontas
- Certifique-se de seguir as regras adequadas para algarismos significativos, conforme necessário.
Artigos sobre o tópico "Calculando a massa molecular"
Оцените, пожалуйста статью
Similar
Popular