Você está sendo solicitado a fazê-lo "porcentagem em massa" de um determinado produto químico para um teste de química. Antes de entrar em pânico, leia primeiro. É muito mais fácil do que parece.
Degraus
Método 1 de 3: Primeiros passos
Uma porcentagem em massa é a massa de um determinado produto químico dividida pela massa total de todos os produtos químicos em uma solução/composto, expressa em porcentagem. Existem duas maneiras de abordar essa questão de porcentagem de massa. Leia abaixo para determinar qual abordagem adotar.
1.
Determine se a questão que você precisa resolver fornece as massas dos produtos químicos ou não.- Quando as massas são dadas. Se na questão a massa das substâncias químicas já for dada, como no caso "Qual é a porcentagem em massa de 5 g de hidróxido de sódio dissolvido em 100 g de água?", em seguida, siga as instruções descritas abaixo na seção "Como você determina a porcentagem de massa para determinadas massas".
- Se as massas não são dadas. Às vezes, você é solicitado a fornecer a porcentagem em massa, mas a massa dos produtos químicos é desconhecida. Nesses casos, você usará as fórmulas químicas para resolver as massas químicas. Essa pergunta pode ser assim, "Determine a porcentagem em massa de hidrogênio em uma molécula de água?" Em caso afirmativo, siga as instruções na seção "Como você determina a porcentagem de massa, se as massas não são dadas".
Método 2 de 3: Como você determina a porcentagem de massa para determinadas massas
Abaixo você encontrará os passos necessários para resolver uma questão sobre porcentagem de massa onde a massa das substâncias químicas é dada. Essa pergunta pode ser assim, "Qual é a porcentagem em massa de 5 g de hidróxido de sódio dissolvido em 100 g de água?" Os exemplos nesta seção elaboram esta pergunta.

1.
Calcule a massa total. Some todas as massas de todos os elementos do composto ou solução. Isso lhe dará a massa total. Este é o denominador. anote isso.
- Por exemplo, nesta etapa você fará 100 g + 5 g para a massa total de 105 g.
2. Determine qual é o produto químico solicitado. Quando você for solicitado "porcentagem em massa" você será solicitado a determinar a massa de um determinado produto químico (o produto químico solicitado), como uma porcentagem da massa total de todos os elementos. Determine qual é o seu produto químico em questão. anote isso. Este é o seu contador.
Por exemplo, nesta etapa você determina que o produto químico solicitado é 5 g de hidróxido de sódio.3. Peças. Divida a massa do produto químico solicitado, encontrado na etapa "Determine o produto químico solicitado" , pela massa total calculada em "Calcule a massa total". O resultado desta divisão é a massa.
Por exemplo, nesta etapa você divide 5 g (massa de hidróxido de sódio) por 105 (massa total) e obtém a proporção da massa, 0,04761.4. Calcule a porcentagem. Multiplique a razão da massa encontrada por 100. Isso dá a porcentagem em massa.
Por exemplo, nesta etapa você multiplica 0,04761 por 100 e obtém 4,761%. Portanto, a porcentagem em massa de 5 g de hidróxido de sódio dissolvido em 100 g de água é 4,761%.Método 3 de 3: Como você determina a porcentagem de massa, se as massas não são dadas
Abaixo você encontrará os passos necessários para resolver uma questão sobre porcentagens de massa, onde as massas químicas não são dadas. Essa pergunta pode ser assim, "Determine a porcentagem em massa de hidrogênio em uma molécula de água?" Os exemplos nesta seção resolvem esse problema.

1.
Leia as seguintes definições. Antes de poder calcular a porcentagem em massa em tal problema, você precisará entender os conceitos químicos abaixo.
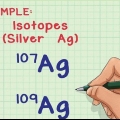
- Tecidos compostos. Um composto é formado pela combinação de dois ou mais elementos químicos diferentes. Esses elementos são mantidos juntos por ligações covalentes ou ligações iônicas. Os elementos em substâncias compostas podem ser separados novamente por reação química.
- Por exemplo. Hidrogênio e oxigênio são elementos químicos diferentes. Uma molécula de água é, portanto, um composto porque consiste em dois átomos de hidrogênio e um átomo de oxigênio.
Fórmulas Químicas. Um composto pode ser citado de forma abreviada. Isso é chamado de fórmula química. Uma fórmula química também leva em conta a quantidade relativa de cada átomo em um composto.Por exemplo. A fórmula química da água consiste em uma "Hã" de hidrogênio e um"O" de oxigênio. Como existem dois átomos de hidrogênio em cada átomo de oxigênio em uma molécula de água, a fórmula química da água terá que consistir em dois H`s por O. Assim, a fórmula química da água é escrita como H2O.A razão molar. A quantidade relativa de um tipo de átomo em comparação com a de outro tipo de átomo em um composto é chamada de número de mols. Você pode descobrir isso olhando para a fórmula química de um composto.Por exemplo. A fórmula química da água é H2O. Ao decompor esta fórmula sabemos que a razão molar de hidrogênio e oxigênio em uma molécula de água é igual a 2:1.
2. Escreva a fórmula química. As fórmulas químicas podem ter sido dadas, mas se não, primeiro anote as fórmulas químicas de cada composto solicitado. Uma vez que as fórmulas químicas são dadas, você pode pular esta etapa e continuar com a etapa"Determine a massa de cada elemento".
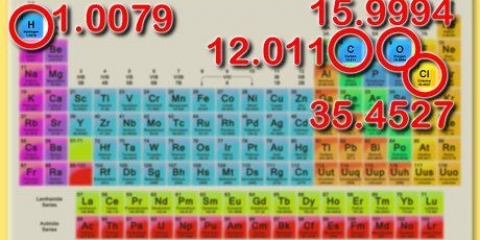
Por exemplo, nesta etapa você tem que escrever a fórmula química da água como H2O.3. Determine a massa de cada elemento. Procure o peso molecular de cada elemento na fórmula química na tabela periódica. anote isso.
Por exemplo, nesta etapa você está procurando o peso molecular do oxigênio, 15,9994; e o peso molecular do hidrogênio, 1,00794.4. Multiplique as massas pela razão molar. Determine quantos mols estão presentes em cada elemento do composto. Multiplique a massa molar pela razão molar. anote isso.
Por exemplo, nesta etapa, a razão molar de hidrogênio e oxigênio na água é 2:1. Portanto, você multiplica a massa molar do hidrogênio por 2. 1,00794 X 2 = 2,01588; e deixe você ter a massa molar do oxigênio como é, 15,9994.5. Calcule a massa total. Some a massa total de todos os elementos em suas composições. Certifique-se de usar as massas da etapa "Multiplique as massas pela razão molar" para levar em conta as razões molares corretas. Escreva isso. Este será o seu denominador.
Por exemplo, nesta etapa você adiciona 2,01588 (a massa de 2 mols de átomos de hidrogênio) por 15,9994 (a massa de 1 mol de átomos de oxigênio) e obtém 18,01528.6. Determine o produto químico solicitado. Quando você for solicitado "porcentagem em massa" então você será solicitado a determinar a massa de um determinado produto químico (o produto químico solicitado) como uma porcentagem da massa total de todos os elementos. Determine o produto químico solicitado. Escreva isso. Este é o denominador.
Por exemplo, nesta etapa você descobre que o produto químico em questão é o hidrogênio.7. Peças. Divida a massa do produto químico solicitado da etapa "Determine o produto químico solicitado" pela massa total calculada em "Calcule a massa total". Este número calculado é a razão de massa.
Por exemplo, nesta etapa você divide 2,01588 (a massa dos átomos de hidrogênio) por 18,01528 (a massa total de uma molécula de água). Isso lhe dará uma proporção de massa de 0,11189.8. Calcule a porcentagem. Multiplique a razão de razão de massa resultante da etapa "Peças" com 100. Isso lhe dará a resposta, a porcentagem em massa.
Por exemplo, nesta etapa você multiplica 0,11189 por 100 e obtém 11,18%. A porcentagem em massa de átomos de hidrogênio em uma molécula de água é 11,18%.Pontas
- Certifique-se de que sua fórmula química esteja equilibrada na etapa "Escreva a fórmula química". Se a fórmula química é dada, então deve estar em equilíbrio. No entanto, se você primeiro for solicitado a resolver uma equação química para criar a fórmula química acima mencionada, verifique se ela está em equilíbrio antes de determinar a porcentagem de massa.
Artigos sobre o tópico "Calcular porcentagem de massa"