Se for um decimal, você provavelmente está olhando para a massa atômica. 
Pode haver um espaço vazio após os elementos 56 (bário) e 88 (rádio). Não há realmente um espaço; os elementos com os números atômicos que pertencem lá estão em duas linhas abaixo do resto do sistema. A única razão pela qual eles são separados assim é para tornar a tabela periódica menos ampla. 
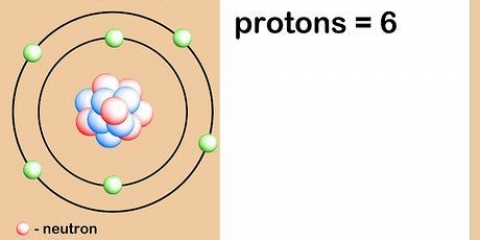
Em outras palavras, qualquer átomo com oito prótons é um átomo de oxigênio. Dois átomos de oxigênio podem ter um número diferente de nêutrons ou (se um for um íon) um número diferente de elétrons, mas ambos sempre terão oito prótons. 

Na prática, a massa atômica geralmente já é dada para problemas de química que lidam com apenas um átomo. Entenda este conceito para não se surpreender se for diferente do peso atômico. 
Isso funciona porque os nêutrons e prótons estão próximos de 1 AMU e os elétrons estão próximos de 0 AMU. Para o peso atômico, medidas precisas são usadas para obter o número decimal, mas estamos interessados apenas nos números inteiros que nos informam o número de prótons e nêutrons. Lembre-se de que, se você usar o peso atômico, obterá uma média para uma amostra típica. Uma amostra de bromo tem um número de massa de cerca de 80, mas, como se vê, um único átomo de bromo quase sempre tem um número de massa de 79 ou 81. 
Um único átomo de hélio (He) tem número de massa 4 e número atômico 2. Portanto, deve ser 4 - 2 = 2 nêutrons Ter. Uma amostra de prata (Ag) tem um número de massa de cerca de 108 (de acordo com a tabela periódica) e um número atômico de 47. Em média, cada átomo de prata na amostra tem 108 - 47 = 61 nêutrons. 
Os isótopos não têm um número atômico diferente. Cada isótopo de um elemento tem o mesmo número de prótons.
Determinar o número atômico de um elemento
Contente
O número atômico de um elemento é o número de prótons no núcleo de um único átomo desse elemento. O número atômico de um elemento ou isótopo não muda, então você pode usar o número atômico para calcular outras características de um elemento ou isótopo, como o número de nêutrons.
Degraus
Parte 1 de 2: Encontrando o número atômico

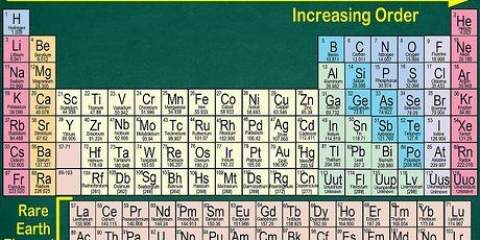
1. Encontre uma cópia da tabela periódica. Você pode encontrar um aqui se você não tiver um à mão. Cada elemento tem um número atômico diferente, portanto, não há métodos rápidos e fáceis de aplicar. Você terá que encontrar uma cópia da tabela periódica ou uma tem que aprender de cor.
- A maioria dos livros de química tem uma tabela periódica impressa na capa interna.

2. Encontre o elemento que você está estudando. A maioria das tabelas periódicas contém os nomes completos dos vários elementos, bem como seus símbolos químicos (como Hg para mercúrio). Se você está tendo problemas para encontrar o elemento, você deve pesquisar online por `símbolo químico` seguido do nome do elemento.

3. Encontre o número atômico. O número atômico geralmente está no canto superior esquerdo ou direito da caixa em que o elemento está, mas também pode estar em outro lugar da caixa. O número atômico é sempre um número inteiro.

4. Verificar contra elementos vizinhos. A tabela periódica é organizada por número atômico. Se o número atômico do seu elemento for `33`, o elemento à esquerda deve ser `32` e o elemento à direita deve ser `34`. Se esta ordem estiver correta, você definitivamente encontrou o número atômico.

5. Entenda o que é o número atômico. Existe uma definição simples para o número atômico de um elemento: o número de prótons em um átomo desse elemento. Esta é a definição básica de um elemento. O número de prótons determina a carga elétrica total do núcleo, que determina quantos elétrons um átomo pode ter. Como os elétrons são responsáveis por quase todas as reações químicas, o número atômico determina indiretamente quase todas as propriedades físicas e químicas de um elemento.
Parte 2 de 2: Encontrando informações relacionadas

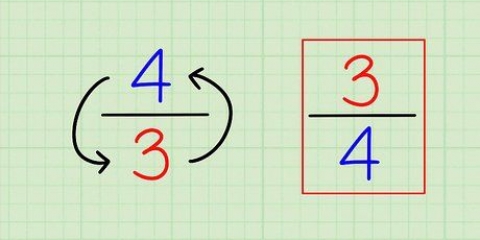
1. Encontrando o peso atômico. O peso atômico geralmente é impresso sob o nome do elemento em questão na tabela periódica e geralmente é calculado com duas ou três casas decimais. Esta é a massa média de um átomo do elemento, ajustada para corresponder ao que você provavelmente encontra na natureza. Este número está em "unidades de massa atômica" (AMU (do inglês "unidade de massa atômica")).
- Alguns cientistas usam o termo "massa atômica relativa" em vez de "peso atômico".

2. Entenda o que é a massa atômica. A massa atômica é um conceito muito semelhante ao de peso atômico. A única diferença é que você está falando de um átomo específico em vez da média de uma amostra. Um grama de ferro contém muitos átomos com massas que diferem ligeiramente entre si, então você procura o `peso relativo` para encontrar a média. Se você está interessado apenas em um átomo de ferro específico, a média não importa para você - você está interessado apenas na massa exata desse átomo em particular.

3. Arredondar para número de massa. O número de massa é o número total de prótons mais nêutrons em um átomo de um elemento. Você pode encontrar esse número facilmente: basta pegar o peso atômico dado na tabela periódica e arredondar para o número inteiro mais próximo.

4. Calcule o número de nêutrons. Agora você sabe que o número atômico = número de prótons, e que o número de massa = número de prótons + número de nêutrons. Para descobrir quantos nêutrons existem em um elemento, você deve subtrair o número atômico do número de massa. Aqui estão alguns exemplos:

5. Entenda o que são isótopos. Um isótopo é uma forma específica de um elemento com um certo número de nêutrons. Quando uma questão de química fala sobre "boro-10" ou "B", eles estão falando sobre o elemento boro com um número de massa de 10. Use este número de massa em vez do valor para boro `típico`.
Pontas
- Alguns elementos mais pesados têm pesos atômicos entre parênteses ou parênteses. Isso significa que o peso atômico é a massa exata do isótopo mais estável, em vez da média de vários isótopos. (Isso não tem efeito sobre o número atômico do elemento.)
Artigos sobre o tópico "Determinar o número atômico de um elemento"
Оцените, пожалуйста статью
Similar
Popular