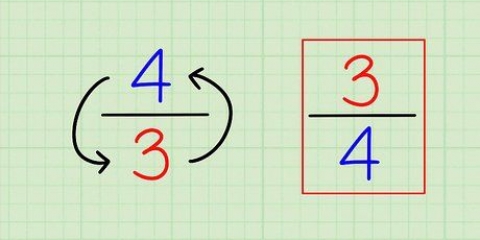
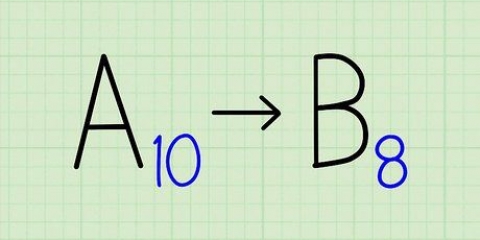N = M - n N = número Neutrons M = átomo mbunda n = átomo nnúmero 




N = M - n N = número Neutrons M = átomo mbunda n = átomo nnúmero
Determine o número de nêutrons em um átomo
Contente
Determinar o número de nêutrons em um átomo é muito fácil e você nem precisa fazer um experimento para isso. Para calcular o número de nêutrons em um átomo ou isótopo tudo que você precisa fazer é seguir estas instruções.
Degraus
Método 1 de 2: Encontrando o número de nêutrons em um átomo

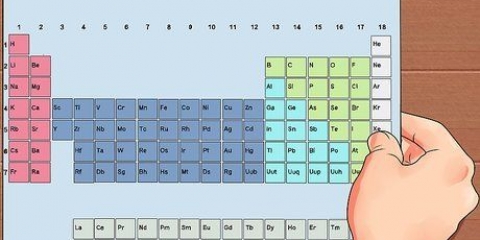
1. Procure o elemento na tabela periódica. Neste exemplo, estamos olhando para Osmium (Os), na linha 6.

2. Encontre o número atômico do elemento. Geralmente é o número acima do símbolo do elemento. (Na tabela que usamos este é o único número.) O número atômico é o número de prótons em um átomo desse elemento. Os tem o número 76, o que significa que um átomo de Ósmio tem 76 prótons.

3. Encontre a massa atômica do elemento. Geralmente é o número abaixo do símbolo do elemento. (Isso não é mencionado na tabela que usamos).Ósmio tem uma massa atômica de 190,23.

4. Arredonde a massa atômica para o número inteiro mais próximo para encontrar a massa atômica. Em nosso exemplo, 190,23 é arredondado para 190, resultando em uma massa atômica de 190 para ósmio.

5. Subtraia o número atômico da massa atômica. Como a maior parte do peso de um átomo é ocupada pelos prótons e nêutrons, subtraindo o número de prótons (por exemplo,. o número atômico) da massa atômica fornece o número de nêutrons no átomo Os números após o ponto decimal representam a massa muito pequena dos elétrons no átomo. No nosso exemplo é: 190 (massa atômica) – 76 (número de prótons) = 114 (número de nêutrons).

6. Lembre-se da fórmula. Para encontrar o número de nêutrons no futuro, use a seguinte fórmula:
Método 2 de 2: Encontrando o número de nêutrons em um isótopo

1. Procure o elemento na tabela periódica. Como exemplo, olhamos para o isótopo de carbono-14. Como o Carbono-14 é um isótopo do Carbono(C), tente encontrar o carbono na tabela periódica (na segunda linha).

2. Encontre o número atômico do elemento. Geralmente é o número acima do símbolo do elemento. (Na tabela que usamos este é o único número.) O número atômico é o número de prótons em um átomo desse elemento. C é o número 6, o que significa que um átomo de carbono tem 6 prótons.

3. Encontre a massa atômica. Com isótopos isso é muito fácil, porque seu nome é tirado de sua massa atômica. O carbono-14, por exemplo, tem uma massa atômica de 14. Agora que você conhece a massa atômica, todo o processo é como encontrar o número de nêutrons em um átomo comum.

4. Subtraia o número atômico da massa atômica. Como a maior parte do peso de um átomo é ocupada pelos prótons e nêutrons, subtraindo o número de prótons (i.e. o número atômico) da massa atômica produz o número de nêutrons no átomo. No nosso exemplo é: 14 (massa atômica) – 6 (número de prótons) = 8 (número de nêutrons).

5. Lembre-se da fórmula. Para encontrar o número de nêutrons no futuro, basta usar a seguinte fórmula:
Pontas
- Ósmio, um metal que é sólido à temperatura ambiente, leva o nome da palavra grega para cheiro, "osme.”
- Se você não tiver certeza do que um determinado número representa na tabela periódica, lembre-se de que a tabela geralmente é construída em torno do número atômico (número de prótons), que começa no 1 do hidrogênio e vai até 118 (ununoctium). Isso ocorre porque o número de prótons em um átomo determina o átomo, tornando-o a propriedade preferida de um elemento para uma divisão clara. (por exemplo:. um átomo com 2 prótons é sempre hélio, assim como um átomo com 79 prótons é sempre ouro.)
Artigos sobre o tópico "Determine o número de nêutrons em um átomo"
Оцените, пожалуйста статью
Similar
Popular