Cada nível de energia s pode conter até 2 elétrons. Cada nível de energia p pode conter até 6 elétrons. Cada nível de energia d pode conter até 10 elétrons. Cada nível de energia f pode conter até 14 elétrons. 
O nível de energia d tem uma energia ligeiramente maior do que o nível de energia s da camada de elétrons inferior, de modo que o nível de energia s mais alto é mais provável de preencher do que o nível de energia d mais baixo. Para escrever uma configuração eletrônica, isso significa que ficará assim: 1s2s2p3s3p4s3d. 
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p Por exemplo: A configuração eletrônica do sódio (11 elétrons) é: 1s2s2p3s. 
Por exemplo, o sódio está no bloco s, então o último orbital de sua configuração eletrônica é s. Está na terceira linha e na primeira coluna, então o último orbital é 3s. Esta é uma boa maneira de verificar sua resposta final. A regra é um pouco diferente para o orbital d. A primeira linha de elementos do bloco d começa na quarta linha, mas você precisa subtrair 1 do número da linha porque os níveis s têm uma energia menor que os níveis d. Por exemplo: vanádio termina em 3d. Outra maneira de verificar seu trabalho é somar todos os sobrescritos. Eles devem ser iguais ao número de elétrons no elemento. Se você tem poucos ou muitos elétrons, precisa repensar seu trabalho e tentar novamente. 

1: Hélio 2: Néon 3: Argônio 4: Krypton 5: Xenônio 6: Radão Por exemplo, o sódio está no período 3. Usaremos neon para a configuração de gás nobre porque está no período 2. 
Por exemplo, o sódio tem 11 elétrons e o neon tem 10 elétrons. A configuração eletrônica completa do sódio é: 1s22p3s e neônio é 1s22p. Como você pode ver, o sódio tem um 3s que o neon não tem - é por isso que a configuração do gás nobre para o sódio se torna [Ne]3s. Alternativamente, você pode contar os sobrescritos dos níveis de energia até ter dez. Remova esses níveis de energia e deixe de lado o que resta. Se você usar néon para escrever a configuração eletrônica do sódio, você fica com um elétron: [Ne]3s.
Escrevendo a configuração de gás nobre de um elemento
Contente
Escrever uma configuração eletrônica para um elemento é uma boa maneira de observar a distribuição de elétrons em um átomo. Dependendo do elemento, a fórmula pode ser muito longa. Portanto, os cientistas desenvolveram uma notação abreviada que usa um gás nobre para representar elétrons que não são elétrons de valência. Isso simplifica a configuração eletrônica e facilita a compreensão das propriedades químicas do elemento.
Degraus
Parte 1 de 2: A configuração eletrônica normal de um elemento

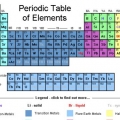
1. Determine o número de elétrons presentes no elemento. O número atômico de um elemento informa quantos prótons ele possui. Como os elementos em seu estado neutro têm o mesmo número de prótons e elétrons, você também pode usar o número atômico como o número de elétrons que o elemento possui. O número atômico, que você pode encontrar no tabela periódica, é o número imediatamente acima do símbolo do elemento.
- Por exemplo: o símbolo do sódio é Na. O número atômico do Na é 11.

2. Conhecimento sobre camadas eletrônicas e níveis de energia. A primeira camada eletrônica tem apenas o nível de energia s, a segunda camada eletrônica tem um nível de energia s e um p. A terceira camada eletrônica tem um nível de energia s, p e d. A quarta camada de elétrons tem um nível de energia s, p, d e f. Existem mais de quatro camadas de elétrons, mas na química do ensino médio você geralmente encontrará apenas as quatro primeiras.

3. Aprenda as regras de preenchimento de elétrons. De acordo com o princípio de Aufbau, você deve adicionar elétrons aos níveis de energia mais baixos antes que um elétron possa ser adicionado a um nível de energia mais alto. Cada nível de energia pode ter vários suborbitais, mas cada suborbital pode conter até dois elétrons a qualquer momento. O nível de energia s tem um suborbital, p tem 3 suborbitais, d tem 5 suborbitais e f tem 7 suborbitais.

4. Use o gráfico de configuração diagonal para escrever configurações eletrônicas. A maneira mais fácil de lembrar como os elétrons são preenchidos é usar o diagrama de configuração. Nele você escreve cada concha e seus níveis de energia. Desenhe linhas diagonais do canto superior direito ao canto inferior esquerdo de cada linha. O esquema de configuração fica assim:
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d 5f
6s 6p 6d
7s 7p

5. Determine o último orbital de qualquer configuração. Observando a tabela periódica, você pode determinar qual será o último subnível e o último nível de energia da configuração eletrônica. Primeiro determine em qual bloco o elemento cai (s, p, d ou f). Em seguida, conte em qual linha o elemento está localizado. Por fim, conte em qual coluna o elemento está localizado.
Parte 2 de 2: A configuração eletrônica do gás nobre

1. Determine a configuração eletrônica do gás nobre. A configuração eletrônica do gás nobre é uma espécie de forma abreviada de escrever a configuração eletrônica completa de um elemento. A abreviação de gás nobre é usada para resumir a configuração eletrônica de um elemento enquanto fornece as informações mais relevantes sobre os elétrons de valência desse elemento.
- O gás nobre é substituído para representar todos os elétrons que não são elétrons de valência.
- Os gases nobres são hélio, neônio, argônio, criptônio, xenônio e radônio e estão listados na última coluna da tabela periódica.

2. Identifique o gás nobre no período para o seu elemento. O período de um elemento é a linha horizontal na qual o elemento está localizado. Se o elemento está na quarta linha da tabela periódica, está no período quatro. O gás nobre que você usará está no período três. Abaixo está uma lista dos gases nobres e seus períodos:

3. Substitua o gás nobre pelo mesmo número de elétrons que o gás nobre possui. Existem algumas maneiras de fazer esta próxima etapa. Você pode escrever a configuração eletrônica do gás nobre e depois substituir essa mesma configuração no elemento de seu interesse. Uma alternativa é remover o mesmo número de elétrons que o gás nobre possui do elemento para o qual você está escrevendo a configuração.
Avisos
- Somente em um átomo neutro o número atômico é igual ao número de elétrons. Um íon contém um número diferente de elétrons. Se o íon tem uma carga de -1, então ele tem um elétron extra. Uma carga -2 tem dois elétrons extras, etc.
Artigos sobre o tópico "Escrevendo a configuração de gás nobre de um elemento"
Оцените, пожалуйста статью
Popular