K Shell (interno): 2 elétrons no máximo. L Shell: máximo de 8 elétrons. M Shell: máximo de 18 elétrons. N Shell: máximo de 32 elétrons. O Shell: máximo de 50 elétrons. P Shell (externo): máximo de 72 elétrons. 
Se a camada de valência estiver cheia, então o elemento é estável. Se a camada de valência não estiver cheia, o elemento é reativo, o que significa que pode formar uma ligação química com o átomo de outro elemento. Cada átomo compartilha seus elétrons de valência na tentativa de preencher a camada de valência. 

O hidrogênio (H) e o hélio (He) têm 1 concha, enquanto o frâncio (Fr) tem 7. Os lantanídeos e actinídeos são agrupados e listados abaixo da tabela principal. Todos os lantanídeos pertencem ao Período 6, Grupo 3 e todos os actinídeos pertencem ao Período 7, Grupo 3. 
Grupo 1: 1 elétron de valência Grupo 2: 2 elétrons de valência Grupo 13: 3 elétrons de valência Grupo 14: 4 elétrons de valência Grupo 15: 5 elétrons de valência Grupo 16: 6 elétrons de valência Grupo 17: 7 elétrons de valência Grupo 18: 8 elétrons de valência – exceto Hélio, que tem 2 

Grupo 3: 3 elétrons de valência Grupo 4: 2 a 4 elétrons de valência Grupo 5: 2 a 5 elétrons de valência Grupo 6: 2 a 6 elétrons de valência Grupo 7: 2 a 7 elétrons de valência Grupo 8: 2 ou 3 elétrons de valência Grupo 9: 2 ou 3 elétrons de valência Grupo 10: 2 ou 3 elétrons de valência Grupo 11: 1 ou 2 elétrons de valência Grupo 12: 2 elétrons de valência
Determinando o número de elétrons de valência
Contente
Os elétrons de valência estão localizados na camada mais externa de um elemento. O número de elétrons de valência em um átomo determina o tipo de ligação química que este elemento pode formar. A melhor maneira de descobrir o número de elétrons de valência é usar a tabela periódica dos elementos.
Degraus
Método 1 de 3: Parte Um: Entendendo os Escudos de Elétron

1. A Tabela Periódica dos Elementos. Esta é uma tabela de códigos de cores, em que cada célula mostra um elemento com seu número atômico e 1 a 3 letras como símbolo.

2. Encontre o número atômico do elemento. O número atômico está acima ou ao lado do símbolo do elemento. Por exemplo: Boro (B) tem número atômico 5, o que significa que tem 5 prótons e 5 elétrons.

3. Desenhe uma representação simples de um átomo e coloque os elétrons em órbita ao redor do núcleo. Essas órbitas também são chamadas de conchas ou níveis de energia. O número máximo de elétrons que podem estar na mesma camada é fixo, e as camadas são preenchidas da órbita mais interna para a mais externa.

4. Encontre o número de elétrons na camada externa. Esses são os elétrons de valência.
Método 2 de 3: Parte Dois: Encontrando elétrons de valência em metais, exceto metais de transição

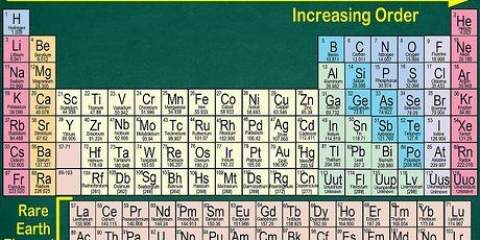
1. Numere cada coluna da tabela periódica, de 1 a 18. O hidrogênio (H) está no topo da coluna 1 e o hélio (He) está no topo da coluna 18. Estes são os diferentes grupos de elementos.

2. Numere cada linha, de 1 a 7. Estes são os períodos dos elementos e correspondem ao número de camadas ou níveis de energia de um átomo.

3. Localize um elemento que não seja um metal de transição. Os metais de transição estão nos grupos 3 a 12. Os números dos grupos dos outros metais indicam o número de elétrons de valência.
Método 3 de 3: Parte Três: Encontrando elétrons de valência em metais de transição

1. Encontre um elemento dos grupos 3 a 12, os metais de transição.

2. Determine o número de elétrons de valência com base no número do grupo. Esses números de grupo correspondem a um número possível de elétrons de valência.
Pontas
- Os metais de transição podem ter camadas de valência que não estão completamente cheias. Determinar o número exato de elétrons de valência em metais de transição requer certos princípios da teoria quântica que estão além do escopo deste artigo.
Necessidades
- Tabela Periódica dos Elementos
- Lápis
- Papel
Artigos sobre o tópico "Determinando o número de elétrons de valência"
Оцените, пожалуйста статью
Similar
Popular