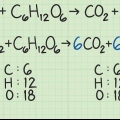
Se houver números próximos aos reagentes, esses são os coeficientes. Estes representam a razão na qual os reagentes são incorporados. O reagente limitante é o material de partida que se esgotará primeiro. Em reações com vários materiais de partida, a reação parará assim que um dos materiais de partida for usado, a menos que todos os materiais de partida sejam absorvidos na mesma proporção. 
Para calcular a massa molar de uma molécula, você soma as massas atômicas de cada átomo na substância. A massa atômica é o número sob o símbolo químico na tabela periódica. Lembre-se de que todos os números subscritos de uma molécula significam que esses átomos são mais frequentes. 
Se a razão real for maior que a estequiométrica, então o reagente no numerador é maior, significando que o outro reagente é o fator limitante. Se a razão real for menor que a estequiométrica, então o reagente no numerador é apenas o fator limitante. 
Você calcula o número de mols de uma substância produzida por determinados reagentes, multiplicando o número de mols de um reagente pela razão coeficiente produto / coeficiente do reagente. Faça isso para cada reagente. 







Calcular o rendimento da reação
Contente
Na química, o rendimento da reação Se isso eficiência de reação a quantidade de substância produzida por uma reação química. Isto retorno teórico é a quantidade máxima de substância que pode ser produzida em uma reação perfeitamente eficiente. Na realidade, a maioria das reações está longe de ser perfeita – a eficiência de uma reação geralmente é menor do que o que é teoricamente possível. Para expressar a eficiência de uma reação, calcule a eficiência da reação com a fórmula: % retorno = (retorno real/retorno teórico) x 100.
Degraus
Parte 1 de 3: Determine o reagente limitante

1. Comece a escrever a equação química. Isso servirá como uma representação matemática da reação final.
- Se você não tem certeza de como escrever uma equação química, veja o wikiHow sobre este tópico.

2. Determine com quais reagentes você está lidando. Estes são geralmente à esquerda da seta na equação. Estes também são referidos pelo termo "materiais iniciais." É possível (como na parte 2) que haja apenas um reagente.

3. Calcule a quantidade (em mols) de cada reagente. Para fazer isso, divida a massa de cada reagente por sua massa molar.

4. Se você tiver dois reagentes, compare a razão entre os mols e os coeficientes. Essas proporções são chamadas respectivamente "proporção real" e "razão estequiométrica."

5. Se você tiver mais de dois reagentes, precisará calcular quantos mols de cada reagente produzirá quando a reação estiver completa. O reagente que produz a menor quantidade é o fator limitante.
Parte 2 de 3: Calculando o retorno teórico

1. Determine qual deve ser o produto de uma reação. Isso geralmente está no lado direito da seta em uma fórmula química. Neste exemplo, CaO é a substância desejada (CO2 é um gás). O rendimento teórico é uma medida da quantidade de produto que esperamos se a reação for totalmente eficiente.
- Por exemplo: Clair faz 0,45g de nitrato de amônio. Ela prevê um rendimento teórico de 0,50g. Qual é o retorno percentual?
- 0,45/0,50 = 0,9. Multiplique isso por 100 para a porcentagem.
- Retorno percentual = 90%. Anote a massa de cada uma de suas substâncias iniciais.

2. Converta a massa do reagente limitante para o número de mols. Faça isso dividindo a massa do reagente pela massa molar, como na etapa 3, divida 1.

3. A razão experimental. Divida os mols do produto desejado pelos mols do reagente limitante. Isso é chamado de razão experimental.

4. Calcule a massa molar de 1 mol do produto. Registre essa proporção na equação, conforme descrito abaixo.

5. Preveja o retorno teórico. Multiplique o número de mols do reagente limitante pela razão (coeficiente do produto / coeficiente do reagente limitante) e multiplique pela massa molar do produto. Isso lhe dá a massa do produto que você produzirá, se a reação for perfeitamente eficiente (de acordo com o rendimento teórico).
Parte 3 de 3: Calculando o retorno percentual

1. Deixe a reação acontecer. Colete o produto purificado de sua reação e calcule sua massa em uma balança. Observe a massa.

2. Converter a massa do produto em mols dividindo pelo peso molecular. Você faz isso da mesma maneira que na etapa 2, parte 2. Registre o número de moles da substância obtida durante o experimento como o rendimento real.

3. Calcule o retorno percentual. Divida o retorno real pelo retorno teórico e multiplique por 100. A resposta é uma porcentagem, que compara a massa do produto com a massa de uma reação ideal (perfeita).
Avisos
- É possível calcular um retorno percentual maior que 100%, sem errar no cálculo. Se o produto final que você pesa não for puro (contém substâncias que não foram levadas em consideração na comparação química), o resultado não será correto.
- É por isso que é importante purificar com precisão o seu produto através de filtração, secagem, destilação ou de outra forma, dependendo das propriedades da substância do produto.
Artigos sobre o tópico "Calcular o rendimento da reação"
Оцените, пожалуйста статью
Popular