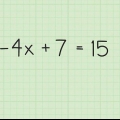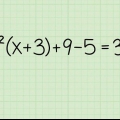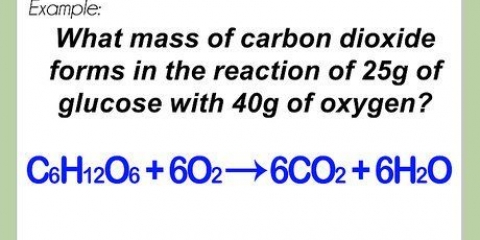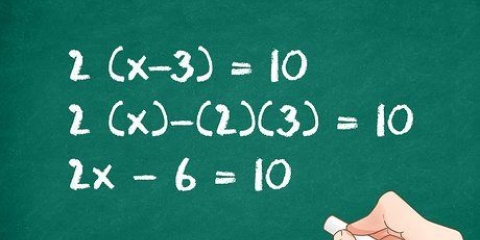Lado esquerdo: 3 carbonos, 8 hidrogênios e 2 oxigênios Lado direito: 1 carbono, 2 hidrogênio e 3 oxigênio O coeficiente 3 para o carbono à direita significa 3 carbonos, assim como o subscrito 3 à esquerda significa 3 carbonos. Em uma equação química, você pode alterar os coeficientes, mas nunca deve alterar os subscritos. À direita adicionamos 4 como coeficiente, pois o subscrito mostrava que já tínhamos 2 átomos de hidrogênio. Quando você multiplica o coeficiente 4 pelo subscrito 2, obtém 8. Os átomos de carbono, hidrogênio e oxigênio estão em equilíbrio. Sua equação está pronta.
Fazendo uma equação de reação correta
Uma equação química é uma representação teórica ou escrita do que acontece durante uma reação química. A lei da conservação da massa diz que os átomos não podem ser criados ou destruídos em uma reação química, então o número de átomos nos reagentes deve equilibrar o número de átomos nos produtos. Siga este guia para aprender a equilibrar equações químicas.
Degraus
1. Escreva sua equação dada. Para este exemplo usamos: C3Hã8 + O2 --> Hã2O + CO2

2. Anote o número de átomos que você tem em cada lado da equação. Olhe para os subscritos ao lado de cada átomo para descobrir o número de átomos na equação.
3. Sempre economize hidrogênio e oxigênio por último. Isso significa que você deve primeiro equilibrar o átomo de carbono. Adicione um coeficiente ao único átomo de carbono no lado direito da equação, para equilibrá-lo com os 3 átomos de carbono no lado esquerdo da equação.
C3Hã8 + O2 → H2O + 3CO2
C3Hã8 + O2 → H2O + 3CO2
4. Em seguida, equilibre os átomos de hidrogênio. Você tem 8 à esquerda, então você deve ter 8 à direita.
C3Hã8 + O2 → 4Hã2O + 3CO2
C3Hã8 + O2 → 4Hã2O + 3CO2
5. Finalmente, equilibre os átomos de oxigênio. Como adicionamos coeficientes às moléculas do lado direito da equação, o número de átomos de oxigênio mudou. Agora temos 4 átomos de oxigênio na molécula de água e 6 átomos de oxigênio na molécula de dióxido de carbono. Isso dá um total de 10 átomos de oxigênio. Adicione um coeficiente de 5 à molécula de oxigênio no lado esquerdo da equação. Agora você tem 10 moléculas de oxigênio em cada lado.
C3Hã8 + 5O2 → 4H2O + 3CO2.
C3Hã8 + 5O2 → 4H2O + 3CO2.
Pontas
- Se você está preso, você pode inserir a equação em um programa de balanceamento online. Lembre-se de que você não pode acessar esse programa durante um exame, portanto, não fique dependente dele.
Avisos
- Nunca use frações como coeficientes em uma equação química – você nunca tem meia molécula ou meio átomo em uma reação química. Para se livrar das frações, multiplique a equação inteira (lados esquerdo e direito) pelo número no divisor da sua fração.
Artigos sobre o tópico "Fazendo uma equação de reação correta"
Оцените, пожалуйста статью
Similar
Popular