A convenção é medir a massa em gramas ou, se houver massa suficiente, em quilogramas. Devido à pequena massa dos gases, eles também são medidos em outra forma de massa, ou seja, massa molecular ou massa molar. A massa molar é definida como a soma da massa atômica de cada átomo na composição que compõe o gás, comparando cada átomo com o valor 12 para o carbono. Como os átomos e as moléculas são muito pequenos para trabalhar, uma quantidade de gás é definida como o número de Mol. O número de mols presentes em um determinado gás pode ser encontrado dividindo a massa pela massa molar, e isso é representado pela letra n. Podemos substituir a constante arbitrária k na equação do gás pelo produto de n, o número de moles e uma nova constante R. A equação agora pode ser escrita como nR = PV/T ou PV = nRT. O valor de R depende das unidades usadas para medir a pressão, volume e temperatura dos gases. Com base no volume em litros, a temperatura em graus Kelvin e a pressão na atmosfera, seu valor é 0,0821 l atm/K mol. Isso pode ser notado como 0,0821 L atm. K mol para evitar o sinal de divisão nas unidades. 
A Lei de Dalton pode ser escrita na forma de uma equação como Ptotal = P1 + p2 + p3 …com tantas adições no final do sinal de igual quanto há gases na mistura. A Lei de Dalton pode ser estendida ao trabalhar com gases cujas pressões parciais individuais são desconhecidas, mas cujo volume e temperatura são conhecidos. A pressão parcial de um gás é a mesma que a pressão desse gás quando é o único gás no recipiente. Para qualquer pressão parcial, podemos reescrever a equação do gás ideal de modo que, em vez de usar a fórmula PV = nRT, tenhamos apenas P à esquerda do sinal de igual. Para fazer isso, dividimos ambos os lados por V: PV/V = nRT/V. Os dois V`s à esquerda se cancelam, deixando-nos com P = nRT/V. Podemos então colocar qualquer instância de P no lado direito da equação de pressão parcial com um subscrito: Ptotal =(nRT/V) 1 + (nRT/V) 2 + (nRT/V) 3 .. 


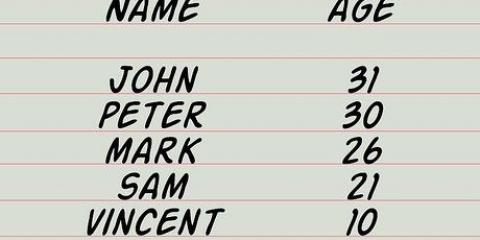
Cada átomo do primeiro gás, nitrogênio (N2), tem um peso atômico de 14. Como o nitrogênio é diatômico (forma moléculas diatômicas), precisamos multiplicar 14 por 2 para calcular que a concentração de nitrogênio na amostra tem uma massa molar de 28. Então dividimos a massa, 10 g, por 28, e obtemos o número de mols, que arredondamos para 0,4 mol de nitrogênio. Cada átomo no segundo gás, oxigênio (O2), tem um peso atômico de 16. O oxigênio também é diatômico, então multiplicamos 16 por 2 e descobrimos que o oxigênio em nosso exemplo tem uma massa molar de 32. Divida 10 g por 32 e teremos cerca de 0,3 mols de oxigênio como resposta. O terceiro gás, o dióxido de carbono (CO2), tem 3 átomos: um átomo de carbono com um peso atômico de 12 e dois átomos de oxigênio, cada um com um peso atômico de 16. Somamos os três pesos: 12 + 16 + 16 = 44 é a massa molar. Divida 10 g por 44 e obtemos cerca de 0,2 mol de dióxido de carbono como resposta. 
Por uma questão de simplicidade, omitimos as unidades dos valores. Essas unidades serão compensadas umas com as outras durante o cálculo, deixando apenas a unidade para exibição da pressão. 

Para a pressão parcial do nitrogênio, multiplicamos 0,4 moles pela nossa constante 0,0821 e a temperatura de 310 graus K, depois dividimos por 2 litros: 0,4 * 0,0821 * 310 / 2 = 5,09 atm. (aproximadamente). Para a pressão parcial de oxigênio, multiplicamos 0,3 mols pela constante 0,0821 e nossa temperatura de 310 graus K, novamente dividindo por 2 litros: 0,3 * 0,0821 * 310 / 2 = 3,82 atm. (aproximadamente). Para a pressão parcial de dióxido de carbono, multiplicamos 0,2 mols pela constante de 0,0821 e nossa temperatura de 310 graus K, que dividimos por 2 litros: 0,2 * 0,0821 * 310 / 2 = 2, 54 atm. (aproximadamente). Agora some cada pressão para obter a pressão total: Ptotal = 5,09 + 3,82 + 2,54, ou 11,45 atm. (aproximadamente). 

0,4 + 0,3 + 0,2 = 0,9 mol da mistura gasosa. Isso simplifica ainda mais a equação em: Ptotal = 0.9*0.0821*310/2. 

Há 0,4 moles de nitrogênio, então 0,4 / 0,9 = 0,44 (44%) da amostra (aproximadamente). Há 0,3 moles de oxigênio, então 0,3 / 0,9 = 0,33 (33%) da amostra (aprox.). Há 0,2 moles de dióxido de carbono, então 0,2 / 0,9 = 0,22 (22%) da amostra (aproximadamente). Embora as porcentagens estimadas acima saiam em 0,99, na realidade os decimais continuam se repetindo, então a soma é na verdade uma série repetida de noves após o ponto decimal. Por definição, isso é o mesmo que 1, ou 100 por cento. 
Multiplique 0,44 * 11,45 = 5,04 atm. (aproximadamente). Multiplique 0,33 * 11,45 = 3,78 atm. (aproximadamente). Multiplique 0,22 * 11,45 = 2,52 atm. (aproximadamente).
Calcular pressão parcial
Contente
Em química, "pressão parcial" refere-se à pressão que qualquer gás em uma mistura de gases exerce em seu ambiente, como um frasco de Erlenmeyer, um cilindro de oxigênio de mergulhador ou o limite da atmosfera. Você pode calcular a pressão de cada gás em uma mistura separadamente se souber quanto desse gás está presente, que volume ele ocupa e qual é sua temperatura. Você pode então somar essas pressões parciais para a pressão total da mistura de gases ou calcular a pressão total primeiro e, em seguida, determinar a pressão parcial de cada gás.
Degraus
Parte 1 de 3: Entendendo as propriedades dos gases

1. Trate qualquer gás como um gás `ideal`. Um gás ideal em química é aquele que interage com outros gases sem ser atraído por suas moléculas. Moléculas individuais podem bater e rebater umas nas outras como bolas de bilhar, sem serem deformadas de forma alguma.
- A pressão dos gases ideais aumenta quando são espremidos em espaços menores e diminui quando recebem mais espaço. Essa relação é chamada de Lei de Boyle, em homenagem a Robert Boyle. Sua equação é k = P x V, ou mais geralmente, k = PV, onde k é a relação constante, P é a pressão e V é o volume.
- A pressão pode ser dada em qualquer uma das unidades de medida possíveis. Uma possibilidade é o Pascal (Pa), definido como a força de um Newton em um metro quadrado. Outra é a atmosfera (atm.), definida como a pressão da atmosfera ao nível do mar. Uma pressão de 1 atm. é igual a 101.325 Pa.
- A temperatura de um gás ideal aumenta ou diminui com o volume do gás. Essa relação é chamada de Lei de Charles, em homenagem a Jacques Charles. Matematicamente, você escreve isso como k = V / T, onde k é a relação constante entre o volume e a temperatura, V é o volume e T é a temperatura.
- Nesta equação, a temperatura dos gases é expressa em graus Kelvin, que podem ser convertidos adicionando 273 ao número de graus Celsius.
- Essas duas relações podem ser combinadas em uma única equação: k = PV / T, que também pode ser escrita como PV = kT.

2. Defina as quantidades em que os gases são medidos. Os gases têm massa e volume. O volume é geralmente medido em litros (l), mas existem dois tipos de massa.

3. Entenda a Lei da Pressão Parcial de Dalton. A Lei de Dalton, como o próprio nome indica, foi desenvolvida pelo químico e físico John Dalton, que foi o primeiro a desenvolver a ideia de que os elementos químicos são compostos de átomos, e afirma que a pressão total de uma mistura gasosa é igual à soma de a pressão de cada um dos gases na mistura.
Parte 2 de 3: Calculando a pressão parcial e total

1. Defina a equação de pressão parcial para os gases com os quais você está trabalhando. Para fins deste cálculo, assumimos que um Erlenmeyer de 2 litros contém 3 gases: nitrogênio (N2), oxigênio (O2) e dióxido de carbono (CO2). Cada gás pesa 10 g e a temperatura de cada gás no Erlenmeyer é de 37 graus Celsius. Precisamos determinar a pressão parcial de cada gás e a pressão total que a mistura gasosa exerce no frasco.
- Nossa equação da pressão parcial agora se torna Ptotal = Pazoto + poxigênio + pdióxido de carbono.
- Como estamos tentando determinar a pressão de cada gás, sabemos seu volume e temperatura e podemos calcular quantos mols de cada gás estão presentes com base em sua massa, podemos reescrever essa equação da seguinte forma: Ptotal =(nRT/V) azoto + (nRT/V) oxigênio + (nRT/V) dióxido de carbono

2. Converter a temperatura para graus Kelvin. A temperatura é de 37 graus Celsius, então adicionamos 273 e obtemos 310 graus K.

3. Determine o número de mols de cada gás presente na amostra. O número de mols de um gás é a massa desse gás dividida por sua massa molar, a soma da massa atômica de cada átomo em sua composição.

4. Preencha os valores para os mols, volume e temperatura na equação. Nossa equação agora fica assim: Ptotal=(0,4 * R * 310 / 2)azoto+(0,3*R*310/2)oxigênio+(0,2 * R * 310 / 2)dióxido de carbono.

5. Insira o valor para a constante R. Vamos relatar as pressões parciais e totais na atmosfera, então vamos usar o valor para R de 0,0821 L atm/K mol. Coloque esse valor na equação e obtemos a resposta: Ptotal dá=(0,4 * 0,0821 * 310 / 2)azoto+(0,3*0,0821*310/2)oxigênio+(0,2 * 0,0821 * 310 / 2)dióxido de carbono.

6. Calcule a pressão parcial para cada gás. Agora que temos os valores, é hora de fazer os cálculos matemáticos.
Parte 3 de 3: Calculando a pressão total e parcial

1. Defina a equação de pressão parcial como antes. Novamente, vamos supor um Erlenmeyer de 2 litros com 3 gases: nitrogênio (N2), oxigênio (O2) e dióxido de carbono (CO2). Há 10 g de cada gás, e a temperatura de cada gás no frasco é de 37 graus Celsius.
- A temperatura Kelvin ainda é de cerca de 310 graus e, como antes, temos cerca de 0,4 mol de nitrogênio, 0,3 mol de oxigênio e 0,2 mol de dióxido de carbono.
- Da mesma forma, vamos registrar a pressão na atmosfera novamente, então usando 0,0821 L atm/K mol como o valor da constante R.
- Assim, a equação da pressão parcial ainda parece a mesma neste ponto: Ptotal=(0,4 * 0,0821 * 310 / 2)azoto+(0,3*0,0821*310/2)oxigênio+(0,2 * 0,0821 * 310 / 2)dióxido de carbono.

2. Some os mols de cada gás na amostra para determinar o total de mols na mistura de gases. Como o volume e a temperatura são os mesmos para cada amostra no gás, sem mencionar que cada valor molar é multiplicado pela mesma constante, podemos usar a propriedade distributiva da matemática para reescrever a equação como Ptotal = (0,4 + 0,3 + 0,2) * 0,0821 * 310 / 2.

3. Determine a pressão total da mistura gasosa. 0,9 * 0,0821 * 310 / 2 = 11,45 moles (aprox.).

4. Determine quanto cada gás compõe da mistura total de gases. Você faz isso dividindo o número total de mols pelo número de mols de cada gás.

5. Multiplique a quantidade proporcional de cada gás pela pressão total para determinar a pressão parcial.
Pontas
- Você basicamente notará uma pequena diferença nos valores que vão da pressão parcial e depois determinando a pressão total, em comparação com a determinação da pressão total primeiro e depois a pressão parcial. Tenha em mente que os valores indicados são aproximações, devido ao arredondamento para 1 ou 2 casas decimais (para que sejam mais fáceis de entender. Se você mesmo fizer os cálculos com uma calculadora sem arredondamento, notará uma diferença menor entre os dois métodos ou nenhuma diferença.
Avisos
- O conhecimento das pressões parciais dos gases pode ser a vida ou a morte para mergulhadores. Uma pressão parcial de oxigênio muito baixa pode causar inconsciência ou morte, enquanto uma pressão parcial muito alta de nitrogênio e oxigênio também pode ser tóxica.
Necessidades
- Calculadora
- Livro de referência sobre pesos atômicos/massas moles
Artigos sobre o tópico "Calcular pressão parcial"
Оцените, пожалуйста статью
Popular