Você pode continuar coletando o gás enquanto a reação ocorrer. Para demonstrações em sala de aula, você só precisa de uma pequena quantidade de ácido clorídrico, que é diluído a 1 M - uma concentração de 2 M funciona melhor, mas deve ser usada com cuidado extra, pois é um ácido forte. A equação é: CaCO3(s) + 2HCl(aq) ==> CaCl2(aq) + H2O(l) + CO2(g). Tenha muito cuidado ao trabalhar com ácido clorídrico - use luvas, jaleco e óculos de proteção e não deixe o ácido entrar em contato com a pele! É melhor realizar esta reação apenas dentro de um ambiente de laboratório. 


Coloque 1 colher de chá de hidróxido de cálcio em uma garrafa de vidro limpa de 4 litros ou menor. A água de cal é uma solução saturada, o que significa que haverá um produto químico extra que não se dissolverá. Uma colher de chá resultará em uma solução totalmente saturada, quer você pegue uma garrafa de 4 litros ou uma menor. Encha a garrafa com água destilada. É melhor usar água destilada para este experimento, pois fornecerá uma solução mais pura. Feche a garrafa com uma tampa. Agite a solução vigorosamente por 1-2 minutos e depois deixe repousar por 24 horas. Despeje a solução purificada do topo da jarra através de um filtro de café limpo ou papel de filtro. Tenha cuidado para não agitar o sedimento. Se necessário, repita esta filtragem até obter uma solução de cal límpida. Mantenha isso em uma jarra ou garrafa limpa. 
Se você não quiser fervê-lo, você também pode usar uma seringa de gás para remover o CO2 diretamente no tubo de ensaio de água de cal meio cheio. Tampe o tubo de ensaio e agite vigorosamente por 1-2 minutos. Se houver dióxido de carbono na amostra, a solução deve ficar turva. 

Se você tem o CO2 através da água de cal por um longo período de tempo, a água acabará se tornando clara. Isso ocorre devido a uma reação química! Aqui está esta resposta: CO2 + Hã2O ==> Hã2CO3 (dióxido de carbono + água = dióxido de carbono) Hã2CO3 + CaCO3 ==> Ca(HCO3)2(ácido carbônico + carbonato de cálcio = hidrogenocarbonato de cálcio) O hidrogenocarbonato de cálcio é solúvel em água, tornando sua solução transparente! 



Testando se um gás é dióxido de carbono
Contente
Dióxido de carbono (CO2) é incolor e inodoro, então você não pode detectá-lo por observação direta. Você precisa coletar uma amostra de ar (ou um CO2 amostra) e, em seguida, execute um dos muitos testes simples para determinar a presença do gás. Você pode fazer o gás passar por água calcária ou segurar uma lasca de madeira brilhante no gás para ver se a presença de CO2 está extinto.
Degraus
Método 1 de 3: Prepare uma amostra

1. Colete um CO2 amostra. Para iniciar seu teste, você precisará de um tubo de ensaio selado cheio de gás coletado. Você pode capturar dióxido de carbono em uma garrafa de gás, tubo de ensaio aquecido ou outro recipiente hermético. A coleta geralmente ocorre acima da água em um copo medidor. CO2 o gás é mais denso que o ar, então você pode pegá-lo usando `down delivery` ou uma seringa.

2. Misturar carbonato de cálcio com ácido clorídrico (HCl). A maneira mais fácil de capturar dióxido de carbono é reagindo carbonato de cálcio (ou lascas de cal) com ácido clorídrico. Primeiro despeje 20 ml de HCl em um Erlenmeyer. Adicione uma colher de carbonato de cálcio (ou lascas de calcário) ao HCL. Quando a reação começar, cubra o Erlenmeyer com uma rolha e cano: você coleta o gás pelo cano e em um tubo de ensaio invertido (que é submerso em uma tigela de água). Se o nível da água no tubo de ensaio mudar, o gás é coletado.

3. Feche o tubo de ensaio com uma rolha (o `tampão`). Por segurança, coloque o tubo de ensaio em um rack até que você vá realizar o teste. O `bung` é essencialmente uma pequena rolha ou tampa que permite direcionar o conteúdo do tubo de ensaio para outro lugar através de um tubo conectado. É importante reduzir o CO2 desligue o gás no recipiente. Se você deixá-lo aberto, o gás se misturará com o ar e seu teste será muito menos eficaz.
Método 2 de 3: Passe o gás pela água de cal

1. Passe o gás através da água de cal. A maneira mais eficaz de testar o CO2 é passando o gás através de `água de cal` (uma solução diluída de hidróxido de cálcio (cal apagada)). Quando você borbulha dióxido de carbono através da solução, ele forma um precipitado sólido de carbonato de cálcio e calcário. O carbonato de cálcio é insolúvel em água. Então, se houver CO2 presente na amostra, a água de cal ficará turva leitosa.
- A água de cal também é chamada de `lavagem branca` ou `leite de cal`. Quando você vê esses termos, você sabe que está lidando com água de cal.

2. Faça uma solução de cal. O processo é simples: diluir hidróxido de cálcio com água. Hidróxido de Cálcio (Ca(OH))2) é um pó branco incolor que você pode comprar na maioria das farmácias. A água de cal pura, uma vez misturada, é límpida e incolor, com um leve odor terroso e o sabor amargo e alcalino do hidróxido de cálcio, pois seu valor de pH é 12,3. Siga estes passos para fazer sua própria água de cal:

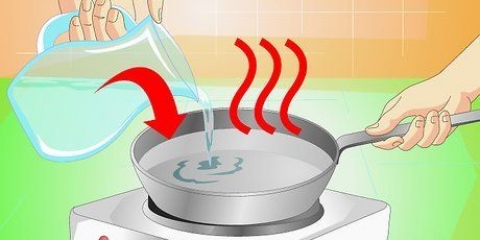
3. Passe o gás através da água de cal. Encha um tubo de ensaio até a metade com água de cal – depois ferva. Use um tubo para medir o conteúdo do CO2 tubo de ensaio de teste diretamente na água de cal fervente. Você pode usar um tubo flexível ou um canudo (de metal) como tubo, se não houver nada melhor por perto. Deixe o gás coletado `borbulhar` através do líquido e espere que a reação ocorra.

4. Cuidado com a água turva. Se CO2 presente, a água de cal ficará branca leitosa das partículas de carbonato de cálcio, pois a solução de carbonato de cálcio é insolúvel e precipitará da solução. Se a água de cal estiver fervendo e o gás for alimentado diretamente na água de cal, a reação deve começar imediatamente. Se nada acontecer após cerca de um minuto, você pode assumir com segurança que não há dióxido de carbono em sua amostra.

5. Aprenda a reação química. Entenda o que exatamente acontece para detectar a presença de CO2 indicar. A equação para o teste é: Ca(OH)2 (aq) + CO2 (g) ==> CaCO3 (s) + H2O (l). Em linguagem simples: água de cal líquida + gás (que CO2 contém) reage com cal (as partículas) e água.
Método 3 de 3: Testando com uma lasca de madeira brilhante

1. Verifique se o gás extingue o fogo. Dióxido de carbono em altas concentrações, extingue incêndios. Tudo o que você precisa fazer é segurar uma pequena chama acesa em um tubo de ensaio que você suspeita conter CO2 contém. Se o gás estiver presente, a chama deve ser extinta imediatamente. A ignição (criar uma chama) é a reação do oxigênio com outra substância; é uma oxidação rápida do composto orgânico e uma diminuição do oxigênio. O fogo se apaga porque o oxigênio é substituído pelo CO2, que não é um gás combustível.
- Observe que qualquer gás livre de oxigênio também extinguirá uma chama dessa maneira. Portanto, este é um teste não confiável para dióxido de carbono e pode levar à identificação incorreta do gás.

2. Colete o gás em um tubo de ensaio invertido. Certifique-se de que a amostra esteja devidamente armazenada e selada antes de tentar testar o CO2. Esteja razoavelmente certo de que o tubo de ensaio não contém gases inflamáveis ou explosivos - nesse caso, o fogo como teste pode ser perigoso ou, no mínimo, muito assustador.

3. Coloque uma pequena chama no tubo de ensaio. Use uma espátula ou uma longa e fina tira de madeira. Um fósforo ou isqueiro também será suficiente, mas quanto mais longe suas mãos estiverem da abertura do tubo de ensaio, mais seguro será seu experimento. Se a chama se apagar imediatamente, provavelmente há uma alta concentração de CO2 presente no tubo de ensaio.

4. Alternativamente, você também pode usar uma seringa de gás para apagar uma vela. Encha uma seringa com dióxido de carbono. Em seguida, use uma gota de cera derretida para aplicar uma vela curta na superfície de uma moeda. Em seguida, coloque a vela e a moeda em um copo largo e acenda a vela. Coloque o tubo na seringa e injete o CO2 para o fundo do copo. Se você empurrar todo o conteúdo da seringa em um ou dois segundos, a chama deve se apagar.
Necessidades
- água de Lima
- Tubo de ensaio resistente ao calor
- seringa de gás
- Tubo (tubo de alimentação)
- CO2 amostra (ou apenas água)
Artigos sobre o tópico "Testando se um gás é dióxido de carbono"
Оцените, пожалуйста статью
Popular