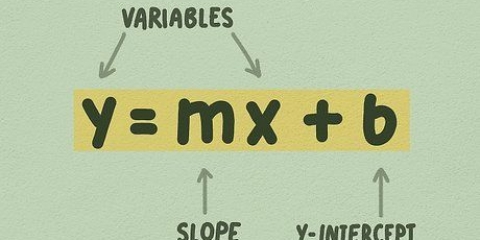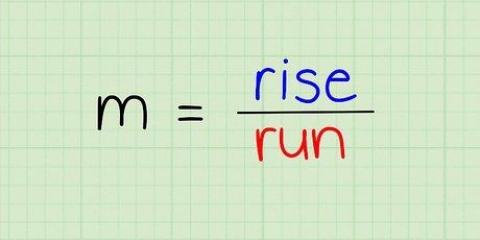A absorbância medida entre as diferentes leituras pode variar devido à concentração da solução e ao formato do recipiente usado para medir a intensidade. A absorbância molar compensa essas variações. 
Prepare uma solução com um conhecido concentração, c, para análise. A unidade de concentração é dada em mols ou mols/litro. Para eu encontrar, medir o comprimento da cuvete. A unidade para o comprimento do caminho é centímetros. Use um espectrofotômetro para obter a leitura de absorbância uma em um determinado comprimento de onda. A unidade para comprimento de onda é metros, mas a maioria dos comprimentos de onda são tão pequenos que na verdade são medidos em nanômetros (nm). Absorbância não tem unidade. 
Por exemplo: com uma cubeta de 1 cm, você mede a absorbância de uma solução com concentração de 0,05 mol/L. A absorbância em um comprimento de onda de 280 nm é 1,5. Qual é a absorbância molar desta solução?? ɛ280 = A/lc = 1.5/(1 x 0.05) = 30 L mol cm 

Desenhe uma linha entre cada um dos pontos. Se as medições estiverem corretas, os pontos devem formar uma linha reta indicando que a absorbância e a concentração correspondem à lei de Beer. 
A equação da inclinação ou inclinação de uma linha é (Y2 - S1)/(X2 - X1). O ponto mais alto na linha recebe 2 como subscrito e o ponto mais baixo recebe 1 como subscrito. Por exemplo, a absorbância em uma concentração molar de 0,2 é 0,27 e em uma concentração molar de 0,3 a absorbância é 0,41. Os valores da absorbância são valores Y enquanto as concentrações são valores X. Usando a equação de uma linha, calculamos: (Y2 - S1)/(X2 - X1) = (0.41-0.27)/(0.3-0.2) = 0.14/0.1 = 1.4 é a inclinação da linha. 
Continuando nosso exemplo: se 1,4 é a inclinação da linha e o comprimento do caminho é 0,5 cm, então a absorbância molar é 1,4/0,5 = 2,8 L mol cm.
Cálculo da absorbância molar
Contente
A absorbância molar, também conhecida como coeficiente de extinção molar, é uma medida da absorção de um determinado comprimento de onda de luz por uma substância química. Ele permite que você faça comparações entre compostos sem levar em conta as diferenças de concentração ou comprimento da solução durante as medições. É frequentemente usado em química e não deve ser confundido com o coeficiente de extinção, pois geralmente é usado em física. As unidades padrão para absorbância molar são litros por mole centímetro (L mole cm).
Degraus
Método 1 de 2: Calculando a absorbância molar com uma equação

1. Entenda a lei de extinção de Beer-Lambert, A = lc. A equação padrão para absorbância é A = lc, verdadeiro uma representa a quantidade de luz absorvida pela amostra para um determinado comprimento de onda, ɛ é a absorbância molar, eu é a distância que a luz percorre através da solução, e c é a concentração dos absorventes por unidade de volume.
- A absorção também pode ser calculada usando a razão entre a intensidade de uma amostra de referência e a amostra desconhecida. Isso é dado pela equação A = registro10(EUO/EU).
- A intensidade pode ser obtida usando um espectrofotômetro.
- A absorbância de uma solução muda dependendo do comprimento de onda na solução. Alguns comprimentos de onda serão absorvidos mais do que outros, dependendo da composição da solução. Não se esqueça de mencionar qual comprimento de onda você usa para o cálculo.

2. Reorganize a equação de Beer-Lambert para resolver a absorbância molar. Usando álgebra, podemos dividir a absorbância pelo comprimento e pela concentração, para isolar a absorbância molar em um lado da equação: ɛ = A / lc. Agora podemos usar esta equação básica para calcular a absorbância molar para um determinado comprimento de onda.

3. Obtenha os valores para as variáveis na equação usando espectrofotometria. Um espectrofotômetro é um dispositivo que envia um comprimento de onda específico de luz através de uma substância e detecta quanta luz sai novamente. Parte da luz será absorvida pela solução e a luz restante que é transmitida pode ser usada para calcular a absorbância dessa solução.

4. Aplique os valores das variáveis à equação de absorbância molar para resolver. Usando os valores que você obteve para uma, c e eu, preencha a equação ɛ = A / lc dentro. Multiplicar eu de c e compartilhar uma então através do produto, para obter a absorbância molar.
Método 2 de 2: Calculando a absorbância molar usando a melhor solução

1. Meça a intensidade da luz transmitida através de várias concentrações de uma solução. Faça três ou quatro concentrações de uma solução. Use um espectrofotômetro para medir a absorbância de uma concentração de solução em um determinado comprimento de onda. Comece com a concentração mais baixa da solução e vá subindo até a mais alta. A ordem não é importante, mas é importante qual absorbância pertence a qual cálculo.

2. Plote a concentração contra a absorbância em um gráfico. Use os valores obtidos com o espectrofotômetro para traçar um gráfico. Para cada valor individual coloque a concentração no eixo x e a absorbância no eixo y.

3. Especialdeclive da linha de melhor ajuste, usando os pontos no gráfico. Para calcular a inclinação da linha, divida a absorbância pela concentração. Usando dois dos pontos do gráfico, subtraia os valores X e Y e, em seguida, calcule Y/X.

4. Divida a inclinação da linha pelo comprimento do caminho (a profundidade/largura da cubeta) para calcular a absorbância molar. O último passo para calcular a absorbância molar com pontos de dados é dividir pelo comprimento do caminho. Esta é a profundidade da cubeta usada no espectrofotômetro.
Artigos sobre o tópico "Cálculo da absorbância molar"
Оцените, пожалуйста статью
Popular