Se a ordem de ligação for zero, a molécula não pode formar. As ordens de ligação mais altas dão mais estabilidade à nova molécula. 


Dependendo do tamanho e da complexidade de um átomo em particular, ele pode ter de um a quatro orbitais. Quando a camada orbital mais próxima estiver cheia, novos elétrons se acumularão na próxima camada orbital vista do núcleo, até que essa camada também esteja cheia. O conjunto de elétrons continua em camadas orbitais cada vez maiores, porque átomos maiores têm mais elétrons do que átomos menores. 
A estrutura de Lewis para o nitrogênio diatômico torna-se N≡N. Cada átomo de nitrogênio tem um par de elétrons e três elétrons não ligados. Quando dois átomos de nitrogênio se encontram, os seis elétrons não ligados combinados formam uma poderosa ligação covalente tripla. 

Elétrons de ligação: Ao observar quão cheias estão as camadas orbitais de cada átomo, você pode determinar quantos elétrons em um estado de energia mais alto são capazes de preencher os níveis de energia mais estáveis e mais baixos do átomo correspondente. Esses elétrons de "preenchimento" são chamados de elétrons de ligação. Elétrons antiligantes: Quando dois átomos tentam formar uma molécula compartilhando elétrons, alguns elétrons serão realmente direcionados para camadas orbitais de nível mais alto de energia porque as camadas orbitais de nível mais baixo de energia são preenchidas. Esses elétrons são chamados de elétrons antiligantes.
Calculando a ordem de ligação em química
Contente
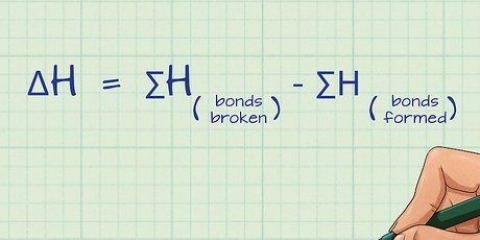
No nível atômico, a ordem de ligação é o número de pares de elétrons ligados entre dois átomos. O nitrogênio diatômico (N≡N), por exemplo, tem ordem de ligação 3 porque existem 3 ligações químicas entre dois átomos de nitrogênio. Na teoria dos orbitais moleculares, a ordem de ligação também é definida como metade da diferença entre o número de elétrons ligados e não ligados. Para uma resposta clara, use a seguinte fórmula: Ordem de ligação = [(número de elétrons ligando orbitais moleculares) - (número de elétrons em orbitais moleculares antiligantes)]/2.
Degraus
Método 1 de 3: determine rapidamente a ordem do título

1. Conheça a fórmula. Na teoria dos orbitais moleculares, a ordem de ligação é definida como metade da diferença entre o número de elétrons ligantes e antiligantes. Ordem de ligação = [(número de elétrons ligando orbitais moleculares) - (número de elétrons em orbitais moleculares antiligantes)]/2.

2. Saiba que quanto maior a ordem de ligação, mais estável é a molécula. Qualquer elétron adicionado a um orbital molecular de ligação ajudará a estabilizar a nova molécula. Qualquer elétron adicionado a um orbital molecular antiligante desestabilizará a nova molécula. Escreva o novo estado de energia como a ordem de ligação da molécula.

3. Pense em um exemplo simples. Os átomos de hidrogênio têm um elétron na s-camada e essa camada pode conter dois elétrons. Quando dois átomos de hidrogênio se ligam, cada um preenche o s-casca do outro. Dois orbitais de ligação são formados. Nenhum dos elétrons é forçado a se mover para o próximo orbital mais alto, o p-casca & ndash; então nenhum orbital antiligante é formado. Então a ordem da ligação é  , e isso é igual a 1. Isso forma a molécula H2: gás hidrogênio.
, e isso é igual a 1. Isso forma a molécula H2: gás hidrogênio.
 , e isso é igual a 1. Isso forma a molécula H2: gás hidrogênio.
, e isso é igual a 1. Isso forma a molécula H2: gás hidrogênio.Método 2 de 3: Visualizando a Ordem Fundamental de Títulos

1. Determine a ordem de títulos rapidamente. Uma ligação covalente simples tem uma ordem de ligação um, uma ligação covalente dupla tem uma ordem de ligação dois, uma ligação covalente tripla tem uma ordem de ligação três – e assim por diante. Em sua forma mais básica, a ordem de ligação é o número de pares de elétrons ligados que mantêm dois átomos juntos.

2. Pense em como os átomos juntam moléculas. Os átomos individuais em uma molécula são ligados entre si por pares de elétrons ligados. Esses elétrons giram em torno do núcleo de um átomo em `orbitais` que podem conter apenas dois elétrons cada. Se um orbital não estiver `completamente preenchido` - por exemplo., ele contém apenas um elétron ou nenhum elétron – então um elétron não ligado pode se ligar a um elétron livre correspondente de outro átomo.

3. Desenhar Estruturas de Lewis. Esta é uma maneira útil de visualizar como os átomos em uma molécula estão ligados entre si. Desenhe os átomos como suas letras (por exemplo,. H para hidrogênio, Cl para cloro). Indique as ligações como linhas (por exemplo,., `-` para uma ligação simples, `=` para uma ligação dupla e `≡` para uma ligação tripla). Marque os elétrons livres e os pares de elétrons como pontos (exemplo: C:). Depois de desenhar a estrutura de Lewis, conte o número de ligações (a ordem das ligações).
Método 3 de 3: Calcular a ordem de ligação para a teoria orbital

1. Use um diagrama de camadas de orbitais de elétrons como referência. Observe que cada camada está cada vez mais distante do núcleo do átomo. De acordo com a entropia, a energia sempre tenta atingir o estado mais baixo possível. Os elétrons sempre tentam preencher as camadas orbitais mais baixas disponíveis.

2. Saiba a diferença entre orbitais ligantes e antiligantes. Quando dois átomos se juntam para formar uma molécula, eles querem usar os elétrons um do outro para preencher os estados mais baixos possíveis nas camadas orbitais. Os elétrons de ligação são essencialmente elétrons que se unem e caem no estado de energia mais baixo. Elétrons antiligantes são os elétrons `livres` ou não ligados que são empurrados para níveis orbitais mais altos.
Artigos sobre o tópico "Calculando a ordem de ligação em química"
Оцените, пожалуйста статью
Popular