O cloreto de sódio (ou sal de mesa) é um eletrólito que ajuda a melhorar a condutividade da água. A água em si não é um condutor particularmente bom. Ao melhorar a condutividade da água, a eletricidade da bateria flui mais facilmente através dela, para que a água seja melhor dividida em hidrogênio e oxigênio. 
As minas de grafite nos lápis atuam como eletrodos e conduzirão a eletricidade proveniente da bateria. O grafite é muito adequado porque não se dissolve ou é danificado pela água durante o experimento. 
O pedaço de papelão permite que você deixe as minas de grafite dos lápis penduradas na água sem tocar na lateral do vidro. O papelão não tem nenhuma das propriedades do metal, então pode ficar no vidro sem afetar o resultado do experimento. 


Ao fazer isso, a conexão com a bateria está completa e a corrente elétrica da bateria pode ser liberada na água. 
Para que este experimento funcione, o grafite dos lápis não deve tocar a lateral do vidro. Então verifique isso novamente e mova os lápis, se necessário. 
Quando você conecta os clipes jacaré à bateria e grafite, a eletricidade começa a se mover imediatamente. Mais bolhas surgem do gás hidrogênio porque cada molécula de água contém duas vezes mais hidrogênio do que oxigênio.
Produção de hidrogênio e oxigênio por eletrólise
Contente
O processo pelo qual a água (H2O) é decomposto em diferentes tipos de átomos ou elementos (hidrogênio e oxigênio) usando eletricidade é chamado de eletrólise. Esse experimento tem implicações significativas para as aplicações desses dois gases, sendo o hidrogênio uma das fontes de energia mais limpas a que temos acesso. Pode parecer complicado, mas é mais fácil do que você pensa se você tiver os recursos, conhecimentos e habilidades certos.
Degraus
Parte 1 de 2: Configurando o experimento

1. Encha um copo de 350 ml com água morna. Você não precisa encher o copo até a borda, então deixe algum espaço. Quando a água está quente, ela conduzirá eletricidade melhor. No entanto, este experimento também funciona bem com água fria.
- Você pode usar água da torneira ou água engarrafada. Não importa o que você escolhe.
- A água mais quente tem menor viscosidade e permite que os íons que conduzem eletricidade se movam mais livremente.

2. Dissolva 1 colher de sopa (20 gramas) de sal de cozinha na água. Você só precisa despejar o sal na água e mexer um pouco a água para garantir que o sal se dissolva. Agora você tem uma solução salina.

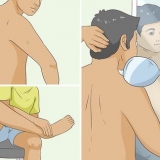
3. Afie 2 lápis HB nas duas pontas para ver o grafite. Certifique-se de remover a borracha no final do lápis. Você precisará apontar os lápis o suficiente para que o grafite fique totalmente exposto em ambas as extremidades.

4. Corte um pedaço quadrado de papelão grande o suficiente para cobrir o vidro. Use papelão que seja grosso o suficiente e permaneça firme quando você fizer furos nele. Por exemplo, corte um quadrado de uma caixa de sapato ou outra caixa de papelão grosso.

5. Faça 2 furos no pedaço de papelão com os 2 lápis. Use os próprios lápis para isso, pois eles precisam ficar bem firmes nos furos para que não se desloquem ou afundem. Se o grafite atingir a lateral ou o fundo do vidro, o experimento será interrompido.
Parte 2 de 2: Executando o experimento

1. Conecte as extremidades das garras jacaré aos terminais da bateria. A bateria é de onde vem a energia elétrica e as garras jacaré garantem que essa energia seja transportada para a água. Prenda uma garra jacaré no terminal positivo e uma garra jacaré no terminal negativo.
- Use uma bateria de 6 volts para isso. Se você não conseguir encontrá-lo, use uma bateria de 9 volts.
- Você pode comprar este tipo de bateria em quase todos os supermercados e lojas de departamento.

2. Anexe as outras extremidades dos clipes de jacaré aos lápis. Certifique-se de que a parte metálica do clipe jacaré toque o grafite do lápis. Você pode precisar cortar um pouco de madeira dos lápis para garantir que os clipes de jacaré entrem em contato total com o grafite.

3. Coloque o pedaço de papelão em cima do vidro para que os lápis fiquem submersos na água. Por causa da maneira como você acabou de cortar o papelão, agora ele deve ficar bem em cima do vidro. Tente fazer isso com cuidado para que os lápis que grudam no papelão não se desloquem ou escorreguem.

4. Veja como a água é decomposta em hidrogênio e oxigênio. As bolhas agora devem subir dos pontos submersos de grafite. Isso significa que o gás hidrogênio e o gás oxigênio são divididos. O gás hidrogênio borbulha do lápis conectado ao terminal negativo e o gás oxigênio do lápis conectado ao terminal positivo.
Pontas
- Se você não encontrar lápis com grafite, também pode usar pedaços curtos de fio. Enrole uma extremidade ao redor da bateria e coloque a outra extremidade na água. Isso tem o mesmo efeito que usar lápis.
- Use uma bateria com uma voltagem diferente. Isso afeta a quantidade de corrente elétrica que passa pela água, o que, por sua vez, afeta a taxa na qual as moléculas de água são divididas.
Avisos
- Se você usar um eletrólito como sal para melhorar a condutividade, saiba que uma pequena quantidade de cloro é produzida como subproduto. Isso não é o suficiente para ser perigoso, mas você pode sentir um leve cheiro de cloro.
- Realize este experimento sob a supervisão de um adulto, pois você estará trabalhando com eletricidade e gases que, por mais improváveis que sejam, podem ser prejudiciais a você.
Necessidades
- 2 lápis HB
- 1 bateria de 6 ou 9 volts
- Copo com capacidade de 350 ml
- 2 clipes de jacaré
- Apontador de lápis
- sal de mesa
Artigos sobre o tópico "Produção de hidrogênio e oxigênio por eletrólise"
Оцените, пожалуйста статью
Popular