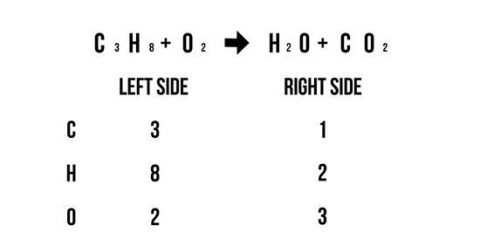
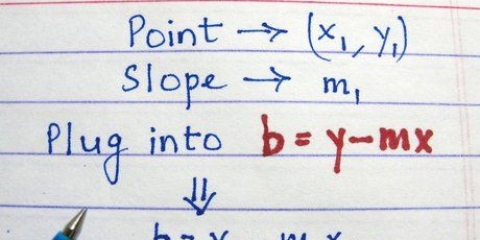Siga estas regras na ordem listada abaixo: Todos Na, K e NH4 os sais são solúveis. Todos NÃO3, C2Hã3O2, ClO3 e ClO4 os sais são solúveis. Todos Ag, Pb e Hg2 os sais não são solúveis. Todos os sais de Cl, Br e I são solúveis. Todos CO3, O, S, OH, PO4, CrO4, cr2O7 e entao3 os sais não são solúveis (com algumas exceções). Todos SO4 os sais são solúveis (com algumas exceções). 
Por exemplo, em NaCl, Na é o cátion carregado positivamente porque é um metal enquanto Cl é o ânion carregado negativamente porque é um não metal. 
Se você fizer um curso padrão de química, provavelmente deverá memorizar alguns dos íons poliatômicos mais comuns. Alguns íons comumente usados são CO3, NÃO3, NÃO2, ASSIM4, ASSIM3, ClO4 e ClO3. Há muitos mais, que você pode encontrar nas tabelas do seu livro de química ou online. 

Se nenhum estado for indicado para um elemento, use o estado conforme indicado na tabela periódica. Se um composto é considerado uma solução, registre-o como líquido ou (aq). Se houver água na equação, determine se a ligação iônica se dissolverá, usando uma tabela de solubilidade. Se a solubilidade é alta, o composto é líquido (aq), se tem uma baixa solubilidade, então é um sólido (s). Se não houver água, então a ligação iônica é um sólido (s). Se o problema se referir a um ácido ou base, a ligação será líquida (aq). Por exemplo, 2Cr + 3NiCl2 --> 2CrCl3 + 3Ni. Cr e Ni são sólidos em sua forma elementar. NiCl2 e CrCl3 são ligações iônicas solúveis e, portanto, são líquidas. Se você reescrever a equação, isso se torna: 2Cr(s) + 3NiCl2(aq) --> 2CrCl3(aq) + 3Ni(s). 
Sólidos, líquidos, gases, ligações moleculares, ligações iônicas pouco solúveis, íons poliatômicos e ácidos fracos não se decompõem. As ligações iônicas com alta solubilidade (use uma tabela de solubilidade) e ácidos fortes irão ionizar para 100% (HCl(aq), HBr(aq), OI(aq), Hã2ASSIM4(aq), HClO4(aq) e HNO3(aq)). Tenha em mente que, embora os íons poliatômicos não se quebrem mais, eles se separarão de uma ligação iônica se forem um componente desse composto. 
Em nosso exemplo: NiCl2 se decompõe em Ni e Cl enquanto CrCl3 se decompõe em Cr e Cl. Ni tem uma carga de 2+ porque Cl tem uma carga negativa, mas há 2 átomos dele. Portanto, deve haver um equilíbrio entre os 2 íons negativos de Cl-. Cr tem uma carga de 3+ porque precisa equilibrar os 3 íons negativos de Cl-. Lembre-se de que os íons poliatômicos têm sua própria carga específica. 
Sólidos, líquidos, gases, ácidos fracos e ligações iônicas pouco solúveis não mudarão seu estado ou se dividirão em íons. Basta deixá-los como estão. Substâncias moleculares se dispersarão em uma solução de modo que seu estado seja alterado para um líquido (aq). Três exceções que não líquido (aq) se tornam: CH4(g), C3Hã8(g) e C8Hã18(eu). Continuando com o exemplo, a equação completa do íon fica assim: 2Cr(s) + 3Ni(aq) + 6Cl(aq) --> 2 Cr(aq) + 6Cl(aq) + 3Ni(s). Quando Cl não faz parte de um composto, então não é diatômico; então multiplicamos o coeficiente pelo número de átomos no composto, para obter 6 íons Cl em ambos os lados da equação. 
Elabore o exemplo: existem íons em excesso de 6Cl em cada lado da equação que podem ser eliminados. A equação final do íon líquido é 2Cr(s) + 3Ni(aq) --> 2 Cr(aq) + 3Ni(s). Você pode verificar se sua resposta está correta verificando se as cargas totais em ambos os lados da equação da reação são iguais.
Criando uma equação de íons líquidos
Contente
As equações de íons líquidos são um aspecto importante da química, pois representam apenas as entidades que mudam em uma reação química. Eles são usados principalmente em reações redox, reações de dupla substituição e neutralizações ácido-base. Existem três etapas básicas para escrever uma equação de íons líquidos: igualar a equação molecular, convertê-la em uma equação de íons completa (como cada substância existe em uma solução) e, em seguida, escrever a equação de íons líquidos.
Degraus
Parte 1 de 2: Entendendo os componentes de uma equação de íons

1. Saiba a diferença entre molecular ecompostos iónicos. O primeiro passo para escrever uma equação iônica líquida é distinguir as ligações iônicas da reação. As ligações iônicas são os compostos que se ionizam em uma solução aquosa e têm uma carga. As ligações moleculares são compostos que nunca têm carga. Eles consistem em dois não metais e às vezes são chamados de ligações covalentes.
- As ligações iônicas podem se formar entre metais e não metais, metais e íons poliatômicos ou múltiplos íons poliatômicos.
- Se você não tem certeza sobre um composto, procure os elementos do composto na tabela periódica.

2. Determinar a solubilidade de uma substância. Nem todas as ligações iônicas são solúveis em solução aquosa e, portanto, não se decompõem em íons fosfato individuais. Você precisa saber a solubilidade de cada substância antes de passar para o resto da equação. Abaixo está um breve resumo das regras de solubilidade. Encontre uma tabela de solubilidade para obter mais informações e exceções a essas regras.

3. Determinar o cátion e o ânion em uma composição. Os cátions são os íons positivos em um composto e geralmente os metais. Os ânions são os íons negativos e não metálicos no composto. Alguns não metais são capazes de formar cátions, mas os metais sempre formam cátions.

4. Reconhecer os íons poliatômicos na reação. Íons poliatômicos são moléculas que estão tão fortemente ligadas umas às outras que não se desintegram durante as reações químicas. É importante ser capaz de reconhecer íons poliatômicos porque eles têm uma carga específica e não se decompõem em seus componentes individuais. Os íons poliatômicos podem ser carregados positivamente ou negativamente.
Parte 2 de 2: Uma equação de íons líquidos

1. Verifique se a equação da reação está em equilíbrio. Antes de escrever uma equação de íons líquidos, você deve primeiro certificar-se de que a equação inicial é completamente está em equilíbrio. Para tornar uma equação igual em ambos os lados da seta de reação, coloque coeficientes para os compostos até que haja um número igual de átomos para cada elemento, em ambos os lados da equação.
- Escreva o número de átomos que compõem cada composto em cada lado da equação.
- Coloque um coeficiente para cada elemento que não seja oxigênio ou hidrogênio para equilibrar a equação.
- Faça o número de átomos de hidrogênio igual em ambos os lados.
- Faça o número de átomos de oxigênio igual em ambos os lados.
- Conte o número de átomos em cada lado da equação novamente para ter certeza de que eles são iguais.
- Por exemplo, Cr + NiCl2 --> CrCl3 + Ni torna-se 2Cr + 3NiCl2 --> 2CrCl3 + 3Ni.

2. Determine os estados de cada composto na equação. Muitas vezes você será capaz de apontar palavras-chave em uma declaração, que deixa claro qual é o estado de cada conexão. Existem várias regras para determinar o estado de um elemento ou composto.

3. Determine quais espécies irão se decompor (em cátions e ânions individuais) na solução. Quando uma determinada substância ou composto se decompõe, ele se decompõe em seus componentes positivo (cátion) e negativo (ânion). Esses são os componentes que eventualmente se equilibram entre si e, portanto, resultam na equação do íon líquido.

4. Calcule a carga de cada íon separado. Lembre-se de que os metais são o cátion positivo enquanto os não metais são o ânion negativo. Com a tabela periódica você pode determinar qual elemento tem qual carga. Você também precisa equilibrar a carga de cada íon dentro do composto.

5. Escreva a equação com as ligações iônicas solúveis divididas em seus íons individuais. Qualquer coisa que se decomponha ou ionize (ácidos fortes) se dividirá em dois íons diferentes. O estado da matéria permanece o mesmo (aq), mas observe que a equação permanece em equilíbrio.

6. Remova os íons supérfluos eliminando íons idênticos em cada lado da equação. Você só pode se livrar daqueles íons que são completamente idênticos em ambos os lados (carga, subscrito, etc.).). Reescreva a reação sem nenhuma das substâncias eliminadas.
Pontas
- Indique todos os estados das substâncias em todas as equações. Você definitivamente receberá pontos deduzidos se não.
Artigos sobre o tópico "Criando uma equação de íons líquidos"
Оцените, пожалуйста статью
Similar
Popular